微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为??????????????????????????;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;?……?
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是?????????????????????。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是:????????????????????????????????????;
②实验③中溶液变成血红色的离子方程式为???????????????????????????。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是???????????????????????????????????。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有?????????????????????????????????????????????????????。
参考答案:
⑴2Fe3++SO32-+H2O=2Fe2++SO4
本题解析:
该试题通过探讨Fe3+和SO32-之间的反应考查学生对氧化还原反应和盐类的水解反应掌握的基本程度,该试题还通过鼓励学生去大胆的猜想及拓展探究实验,考查学生的基本科学素养。
本题难度:一般
2、填空题 (14分)某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
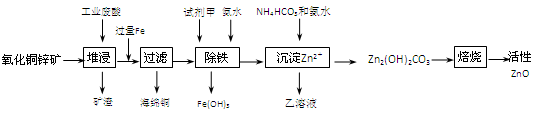
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 6.34
| 9.7
|
Fe3+
| 1.48
| 3.2
|
Zn2+
| 6.2
| 8.0
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)????????Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的????(填序号)作为试剂甲是比较合适的。
A.KMnO4????????? B.HNO3????????? C.H2O2????????????? D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在????????范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式??????????????????????????????????????????????????。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __??????????mol/L以下。
[Fe(OH)3的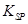 = 2.70×10-39] = 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是??????????。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式????????????????????????。
参考答案:(1)<???????(2)C???(3)3.2~6.2
本题解析:(1)ZnS和CuS均存在溶解平衡:ZnS(s) ZnS(aq)=Zn2++S2-? CuS(s) ZnS(aq)=Zn2++S2-? CuS(s) CuS(aq)=Cu2++S2-,当c(H+)增大的情况下,c(S2-)减小的情况下,前者平衡正向移动,即离子积c(Zn2+)×c(S2-)小于Ksp(ZnS),并且离子积c(Cu2+)×c(S2-)大于Ksp(CuS),则Ksp(ZnS)较大 CuS(aq)=Cu2++S2-,当c(H+)增大的情况下,c(S2-)减小的情况下,前者平衡正向移动,即离子积c(Zn2+)×c(S2-)小于Ksp(ZnS),并且离子积c(Cu2+)×c(S2-)大于Ksp(CuS),则Ksp(ZnS)较大
(2)从表格数据可知,在较低pH下Fe3+已经全部沉淀完全,但Fe2+与Zn2+沉淀的pH范围重合,故需要先用氧化剂将Fe2+氧化,再沉淀除去,为不引入杂质同时不能与加入的氨水反应,H2O2最合适:2Fe2++H2O2+2H+=2Fe3++2H2O
(3)由所给数据可知,为保证Fe3+沉淀完全,但Zn2+不能沉淀,可将pH控制在3.2~6.2之间
(4)Fe3++3NH3·H2O ="==" Fe(OH)3↓+3 NH4+
(5)乙溶液中pH最小为6.2,c(OH—)最小为10—6.2mol/L,c(Fe3+)最大为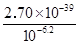 =2.7×10-20.4mol/L =2.7×10-20.4mol/L
(6)(NH4)2 SO4
(7)由流程中参加反应的物质及生成物可知发生的反应为:2ZnSO4 +NH4HCO3 +3 NH3·H2O="=" Zn2(OH)2CO3 ↓+2(NH4)2 SO4 + H2O
本题难度:一般
3、实验题 (12分)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
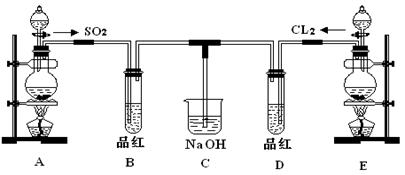
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B:________________________________,D:____________________________。
(2)实验中NaOH溶液的作用是:______________________________________ 。
写出Cl2通入NaOH溶液中的化学方程式_______________________________。
参考答案:(12分)
(1)①反应开始一段时间后,观察到B、D两
本题解析:略
本题难度:一般
4、实验题 工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。 实验室有以下的仪器和药品可供使用: 实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
1)提出假设:
假设1??白色粉末为 ???????????????????????????的混合物;
假设2??白色粉末为 ???????????????????????????的混合物;
假设3??白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
 请回答: 请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是:??????????????????????????????????????????。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。
编号
| 实验操作
| 预期现象和结论
| ①
| 

| 有无色气体产生,说明样品中含有Na2CO3。
若无气体产生,说明样品中没有Na2CO3。
| ②
| 

| ?
| ③
| 

| ?
?
参考答案:(1)3 (1分)1)假设1??碳酸钠、氯化钠
本题解析:略
本题难度:一般
5、实验题 (15分)某实验小组同学对电化学原理进行了一系列探究活动。
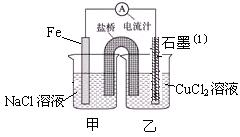
(1)右图为某实验小组依据氧化还原反应:(用离子方程式表示)?????????????????????设计的原电池装置,一段时间后,两电极质量相差12g,导线中通过?????mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为?????????????,这是由于NH4Cl溶液显???性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因???????????????,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式??????????????????,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式????????????。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是????????,电极反应为??????????;乙装置中石墨(1)为?????极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为???????,产物常用?????????检验,反应的离子方程式为????????。
参考答案:
(1)Fe +Cu2+ ="==" Fe2+ + C
本题解析:略
本题难度:简单
|
|