微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室通常用图一所示的装置制取乙酸乙酯。
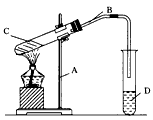
(1)生成乙酸乙酯的反应中,其实是乙醇分子中的乙氧基(CH3CH2O-)取代了乙酸分子中羧基上的羟基(-OH)。若用CH3CH218OH与CH3COOH反应制取乙酸乙酯,写出该反应的方程式(必须在方程式中注明18O在反应物和生成物中的位置):______________________________。
(2)饱和碳酸钠溶液的作用是(填字母)____。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中小,有利于分层析出
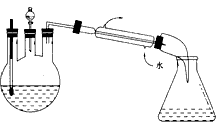
(3)某化学课外兴趣小组设计了如图二所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置均略 去),与上图装置相比,此装置的主要优点有____。
A.增加了温度计,有利于控制发生装置中反应液的温度
B.增加了分液漏斗,有利于及时补充反应混合溶液,以提高乙酸乙酯的产量
C.增加了冷凝装置,有利于收集产物乙酸乙酯
2、填空题 过氧化钙(CaO2)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2。其制备过程如下:
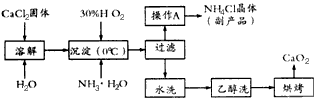
根据以上信息,回答下列问题:
(1)写出制取CaO2·8H2O的化学方程式是_________________________________。
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是_____________________________。
(3)操作A的步骤为__________________________________________。
(4)检验“水洗”已经洗净的方法是___________________________________。
(5)测定含杂质的产品中CaO2含量的实验步骤是:
(已知:①CaO2在酸性条件下将I-氧化为I2②I2+2S2O32-=2I-+S4O62-③杂质不与I-反应)
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入适量2 mol/L的盐酸,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为________________________________。
②产品中CaO2的质量分数为____________________。 (用字母表示)
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数偏高(测定过程中由操作产生的误差忽略不计),可能的原因是___________________。
3、选择题 在实验室制备CH3COOC2H5时在反应试管中不需要添加的试剂是( )
A.C2H5OH
B.CH3COOH
C.浓硫酸
D.碳酸钠溶液
4、实验题 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
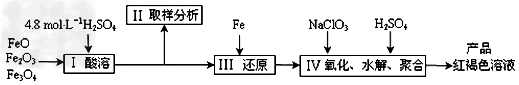
(1)实验室用18.4?mol·L-1的浓硫酸量取_______mL来配制250mL4.8?mol·L-1的硫酸溶液,所用的仪器除烧杯、玻璃棒和移液管外,还需要的玻璃仪器_____________。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_____________。
A.控制溶液中Fe2+与Fe3+含量比???????
B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量?????
D.确保铁的氧化物酸溶完全
(3)①写出步骤Ⅳ中用NaClO3氧化时的离子方程式____________________(提示:ClO3-转化为Cl-);
②已知1mol?HNO3的价格为0.16元,1mol?NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是__________,弊是____________。
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+?物质的量之比,有人设计了以下操作
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m?g。
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000?mol/L?KMnO4标准溶液VmL。离子方程式为:5Fe2+?+?MnO4-+?8H+?=?5Fe3+?+?Mn2+?+?4H2O
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是__________________;?
②在(b)步骤中判断达到终点的现象是_______________;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为____________(用含m、V的代数式表示)。
5、实验题 苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。
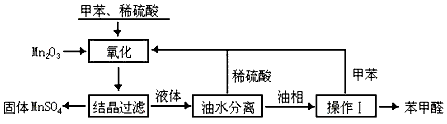
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是____________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是______________________。
(3)实验过程中,可循环使用的物质分别为__________、__________。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是___________,其原理是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
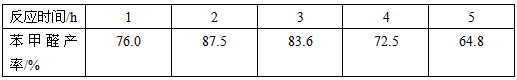
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___________。