微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
实验
编号
| 温度/K
| 盐酸浓度
/mol·L-1
| 醋酸浓度/mol·L-1
| 实验目的
|
①
| 298
| 0.20
| ?
| a.实验①和②,探究温度对反应速率的影响;
b.实验①和③,探究浓度对反应速率的影响;
c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。
|
②
| 308
| 0.20
| ?
|
③
| 298
| 0.40
| ?
|
④
| ?
| 0.20
| 0.20
|
⑤
| ?
| ?
| ?
(1)请完成上工作表(填写实验④⑤的空格)。
(2)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系如图:
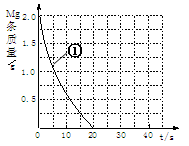
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是????????????。
Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
参考答案:(1)④ 298或308;⑤ 308或298,0.20,0.
本题解析:确实盐酸的体积无法求算出盐酸的速率,应根据第⑷小题表中填写的温度确定,若为298K,则终点在横坐标40处;若为308K,则曲线与①重合,因为镁都溶解不同的酸醋酸的速率小于盐酸。
本题难度:一般
2、填空题 (10分)某同学设计了如图所示的装置(夹持装置已略去)来探究影响化学反应速率的因素。
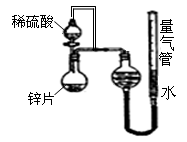
(1)圆底烧瓶中发生反应的离子方程式是
__________________________________________
(2)用上述装置进行实验,以生成15.0mL气体为计时终点,
结果为t1﹥t2
序号
| Ⅴ(H2SO4)/mL
| C(H2SO4)/mol·L-1
| t/s
| Ⅰ
| 10
| 1
| t1
| Ⅱ
| 10
| 3
| t2
?
比较实验Ⅰ和实验Ⅱ可以得出的结论是__________________________________________
(3)实验中向烧瓶中滴入的稀硫酸的体积(其他操作都正确),对测定气体体积的影响_____ __________ (填“偏大”、“偏小”、“无影响”)
(4)将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含的杂质可能是(填序号)________
a.石墨????? b.银????? c.铜????? d.沙粒(二氧化硅)
(5)要加快该反应的反应速率,还可以采取的措施有________________________(任填一种即可)
参考答案:(每空2分) (1)Zn+2H+=Zn2++H2↑
(
本题解析:
试题分析:(1)①锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为Zn+2H+=Zn2++H2↑;②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平。(3)根据所给装置可以看出实验中向烧瓶中滴入的稀硫酸的体积对测定气体体积无影响;(4)由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是石墨、银、铜等;(5)加快该反应的反应速率
本题难度:简单
3、实验题 下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
催化剂(0.1g)
| 活性炭
| FeCl3
| KI
| MnO2颗粒状
| MnO2粉末状
| 前15s产生氧气的量(ml)
| 5
| 11
| 7
| 8
| 11
| 前30s产生氧气的量(ml)
| 8
| 16
| 11
| 11
| 21
| 前45s产生氧气的量(ml)
| 11
| 20
| 15
| 18
| 35
| 前60s产生氧气的量(ml)
| 15
| 24
| 20
| 26
| 49
?
(1)写出H2O2在催化剂作用下分解反应的化学方程式________________________
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是_____________________,
等质量的固体催化剂,颗粒大小对催化效率有什么影响______________________
(3)实验发现新鲜的动物肝脏对H2O2的分解也有显著的催化作用,但当往溶液中加入
盐酸,或给溶液加热时,就会失去催化能力,合理的解释是????????????????????????????
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一
个实验进行验证。_______________________________________________________
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)略
(2)颗粒越小接触面积越大;
(3)强酸强碱高温可能使催化剂失去活性;
(4)选用一种Fe3+的盐溶液,一种含Cl-的盐溶液验证是Fe3+起催化作用,还是Cl-起催化作用。
本题难度:一般
4、实验题 (8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
实验编号
| 锌的状态
| 反应温度/℃
| 收集100mL氢气所需时间
| ①
| 薄片
| 15
| 200
| ②
| 薄片
| 25
| 90
| ③
| 粉末
| 25
| 10
(1)该实验的目的是研究 、 对锌和稀盐酸反应速率的影响。
(2)实验①和②表明 ;
(3)能表明固体的表面积对反应速率影响的实验编号是 和 。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条 。
参考答案:(1)温度和固体的接触面积(固体的形状)
(2)其它条
本题解析:(1)在反应中锌的固体表面积和反应的温度是不同的,所以实验的目的是研究温度和固体的接触面积对反应速率的影响的。
(2)实验①②中温度不同,温度越高,收集等条件氢气所用的时间就越少,即温度升高,反应速率加快。
(3)实验②③中温度相同,但固体的表面积是不同的。
(4)影响化学反应速率的因素除了温度和固体的接触面积之外,还可以是反应物的浓度,或者通过原电池反应来加快反应速率等。
本题难度:一般
5、选择题 改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.降低温度
B.增大压强
C.使用催化剂
D.增大反应物浓度
参考答案:加入催化剂可提高反应物中的活化分子百分数;降低温度降低反应物
本题解析:
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|