过滤
?
参考答案:C
本题解析:
试题分析:A、澄清石灰水与NaHCO3溶液和Na2CO3溶液都反应,错误;B、乙醇与NaCl溶液和Br2都能溶解,错误;C、饱和NaHCO3溶液能与二氧化硫反应生成二氧化碳,并且二氧化碳在碳酸氢钠中的溶解度很小,正确;D、引进了新的杂质氯离子,错误。
本题难度:一般
3、填空题 现有A、B、C、D、E五种溶液,只知道它们的溶质是NaHCO3、Na2CO3、NaOH、HCl、Ca(HCO3)2。为了鉴别开来,各取少量进行如下实验:
(1)A与B混合无明显现象
(2)B与C(或D,或E)混合均有无色气体产生
(3)D与A(或E)混合均有白色沉淀产生
是根据以上现象,写出A~E各物质的名称:
A???????;B???????;C???????;D???????;E???????。
参考答案:氢氧化钠???盐酸???碳酸氢钠???碳酸氢钙???碳酸钠
本题解析:根据B与C、D、E混合均有无色气体产生,可知B为HCl溶液,C、D、E分别为NaHCO3、Na2CO3、Ca(HCO3)2中的一种。
NaHCO3+HCl══NaCl+H2O+CO2↑
Na2CO3+2HCl══2NaCl+H2O+CO2↑
Ca(HCO3)2+2HCl══CaCl2+2H2O+2CO2↑
因此,A为NaOH。根据D与A〔NaOH(aq)〕混合有白色沉淀生成,可知D为Ca(HCO3)2
Ca(HCO3)2+2NaOH══2H2O+CaCO3↓+Na2CO3
根据D〔Ca(HCO3)2(aq)〕与E混合有白色沉淀生成,可知E为Na2CO3
Ca(HCO3)2+Na2CO3══CaCO3↓+2NaHCO3
因此,C为NaHCO3。
本题难度:一般
4、实验题 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。
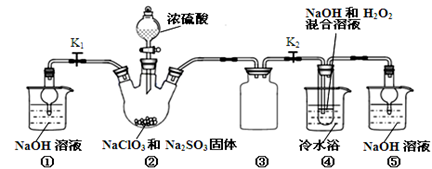
完成下列填空:
(1)装置②中产生ClO2的化学方程式为???????????。装置③的作用是?????????????。
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②??????????;③???????;④低于60℃干燥,得到成品。
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+ 4I-+4H+ →2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。配制待测液需用到的定量玻璃仪器是????????????;
(4)取25.00mL待测液,用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为??????????。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为?????????????。
(5)通过分析说明装置①在本实验中的作用???????????????????????????????。
参考答案:(1)2NaClO3 + Na2SO3 + H2SO4→2C
本题解析:
试题分析:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为2NaClO3 + Na2SO3 + H2SO4=2ClO2 + 2Na2SO4 + H2O;装置③为安全瓶,防止装置②中气体温度降低而产生倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(3)容量瓶要指明规格;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2-——2I2——4S2O32-
n(ClO2-)= 1/4 n(S2O32-)=1/4×20×10-3×2=0.01mol
m(NaClO2)=0.01×90.5=9.05g????该样品中NaClO2的质量分数为9.05g÷10g=0.905
(5)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气。
本题难度:一般
5、实验题 浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑  溶液A 溶液A   莫尔盐 莫尔盐
(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是 ;证明溶液A不含Fe3+的最佳试剂是 (填序号字母)。?
A.酚酞溶液
B.KSCN溶液
C.烧碱溶液
D.KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、 、过滤。?
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质;② 。?
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平 (填“左”或“右”)盘。?
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 。?
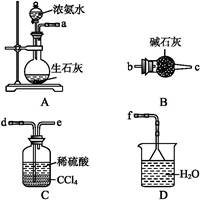
将装置C中两种液体分离开的操作名称是 。装置D的作用是 。?
参考答案:(1)防止Fe2+被氧化为F 本题解析:(1)从Fe2+易被氧化及Fe的还原性角度回答即可;(2)洗涤液应从两个角度回答:①洗去滤渣中的一些杂质;②防止滤渣溶于洗涤液而损耗;(4)由NH3与H2SO4反应制取(NH4)2SO4溶液,一定需要C装置,由“装置D的作用”可知还需要D装置 本题解析:(1)从Fe2+易被氧化及Fe的还原性角度回答即可;(2)洗涤液应从两个角度回答:①洗去滤渣中的一些杂质;②防止滤渣溶于洗涤液而损耗;(4)由NH3与H2SO4反应制取(NH4)2SO4溶液,一定需要C装置,由“装置D的作用”可知还需要D装置
本题难度:一般
|