微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 碘化钠是制备无机和有机碘化物的原料,在医药上用作祛痰剂和利尿剂等。工业上用铁屑还原法制备NaI,其主要流程如下图:
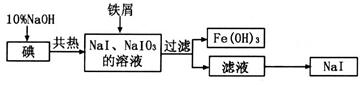
(1)写出铁屑转化为Fe(OH)3反应的离子方程式:????????????????????????????????。
(2)判断碘已完全反应的方法是????????????????????????????????????????????????。
(3)由滤液得到NaI晶体的操作是??????????????????????????????????????????????。
(4)测定产品中NaI含量的方法是:
a.称取3.000g样品溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.100mol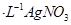 溶液滴定至终点,消耗
溶液滴定至终点,消耗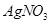 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有?????????????????????????,
其中使用前需进行润洗的仪器是????????????????????????;
②上述样品中NaI的质量分数为??????????????????????????????????????????????。
参考答案:(1)2Fe+IO3?+3H2O=2Fe(OH)3↓+I?(
本题解析:
试题分析:(1)根据流程图可以看出,NaOH与I2共热反应可生成NaI和NaIO3,加入铁屑生成了Fe(OH)3和NaI,所以铁屑转化为Fe(OH)3反应的离子方程式为:2Fe+IO3?+3H2O=2Fe(OH)3↓+I?
(2)利用I2能使淀粉变蓝的现象判断碘是否反应完全:用小试管取溶液少许,向其中滴加几滴淀粉溶液,如果溶液不变蓝色,则证明碘反应完全。
(3)NaI溶液在蒸发水时,没有副反应发生,所以采用蒸发、结晶的方法得到NaI晶体。
(4)①250mL容量瓶、滴定管需要检查是否漏液,滴定管在使用前需要进行润洗。
②根据AgNO3的物质的量求算NaI的物质的量,所以样品中NaI的质量分数为:0.100mol/L×0.019L×150g/mol×10÷3.000g×100%=95%
本题难度:一般
2、填空题 电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:

(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、??????????和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有??????????(填化学式),加入CO3(PO4)2的目的是????????????????。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:???????????????。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
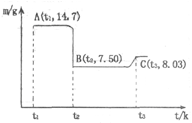
①AB段:??????????????????????;
②BC段????????????????????。
参考答案:(1)玻璃棒(2)Si?调节pH,保证Co2+不沉淀,而使铁
本题解析:
试题分析:(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、玻璃棒和漏斗。(2)在加入硝酸酸化时钴、Fe都与硝酸发生反应得到硝酸钴、硝酸铁而Si不能与稀硝酸发生反应,所以过滤后存在于滤渣A中。因此滤渣A的主要成分除过量的Co3(PO4)3和Fe(OH)3外还有Si。加入CO3(PO4)2的目的是调节pH,保证Co2+不沉淀,而使铁离子全部沉淀。(3)Co与稀硝酸反应生成 Co2+,根据质量守恒定律和电子守恒、电荷守恒,可知该反应的离子方程式为3Co+8H++2NO3-=3Co2++4H2O+2NO↑。(4)滤渣B(CoC2O4)灼烧发生分解反应:CoC2O4 =CoO+CO↑+CO2↑。得到固体为CoO。n(CoC2O4)=14.7g÷147g/mol=0.1mol;根据元素守恒可得m(CoO)=0.1mol×75g/mol=7.5g;而在t3时固体的质量为8.03g.根据质量守恒定律可知在BC段发生了反应:6CoO+O2
=CoO+CO↑+CO2↑。得到固体为CoO。n(CoC2O4)=14.7g÷147g/mol=0.1mol;根据元素守恒可得m(CoO)=0.1mol×75g/mol=7.5g;而在t3时固体的质量为8.03g.根据质量守恒定律可知在BC段发生了反应:6CoO+O2 2Co3O4。
2Co3O4。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值.下列说法正确的是
A.标准状况下,22.4L?H2O中含有的分子数为NA
B.32g?O2中含有的分子数为NA
C.1mol?Al与足量O2反应转移的电子数为NA
D.1L?1mol?L-1?CaCl2溶液中含有的氯离子数为NA
参考答案:B
本题解析:分析:A.水在标准状况下为液态;
B.质量换算物质的量计算分子数;
C.1molAl与足量O2反应转移3mol电子;
D.1molCaCl2中含有2mol氯离子;
解答:A.标准状况下,水是液体,22.4L 水不是1mol含有的分子数不为NA,故A错误;
B.根据公式32gO2物质的量为n= =
=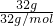 =1mol,含有的分子数为NA,故B正确;
=1mol,含有的分子数为NA,故B正确;
C.铝原子最外层为3个电子,1molAl与足量O2反应转移3mol电子转移的电子数为3NA,故C错误;
D.根 据公式CaCl2物质的量为n=c×V=1mol?L-1×1L=1mol,1molCaCl2中含有2mol氯离子,所以1L?1mol?L-1?CaCl2溶液中含有的氯离子数为2NA,故D错误;
故选B.
点评:本题主要考查了阿伏伽德罗常数的应用,关键答题时正确计算微粒的物质的量,仔细分析微粒间的数量关系,题目难度不大.
本题难度:简单
4、选择题 光纤通讯是一种现代化的通讯手段,光纤通讯容量大,一对光纤可同时传送3万门电话.制造光导纤维的主要原料是SiO2,下列关于SiO2的说法正确的是
A.SiO2的摩尔质量是60
B.1 molSiO2中含有1 molO2
C.1.5 molSiO2中含有18.06×1023个氧原子
D.1 molSiO2的质量是60 g·mol-1
参考答案:C
本题解析:1.5 molSiO2中含氧原子3 mol,即所含氧原子数为:6.02×1023×3=18.06×1023.
摩尔质量的单位是g·mol-1,而质量的单位是g.
本题难度:一般
5、选择题 下列各组物质用酸性高锰酸钾溶液和溴水都能区别的是
A.苯和甲苯
B.1-己烯和己醛
C.苯和1-己烯
D.己烷和苯
参考答案:C
本题解析:本和甲苯都不能使溴水褪色,但甲苯可以是酸性高锰酸钾溶液褪色。1-己烯和己醛都既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,己烷和苯既不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色,所以正确的答案是C。
本题难度:简单