微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子一定能大量共存的是
A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B.在含大量Ba2+的溶液中:NH4+、Na+、Cl-、H+
C.在强碱溶液中:Na+、K+、Cl-、HSO3-
D.在pH =1的溶液中:K+、Fe2+、Cl-、CH3COO-
参考答案:B
本题解析:
试题分析:无色溶液中:Fe2+有颜色,A错误;在含大量Ba2+的溶液中:NH4+、Na+、Cl-、H+,能大量共存,B正确;在强碱溶液中HSO3-不能大量共存,C错误;在pH =1的溶液中,CH3COO-不存在,D错误。
考点:考查离子共存。
本题难度:一般
2、填空题 有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Ba2+、NO3-、SO42-、Cl-、CO32-,实验如下:
实验步骤
| 实验现象
|
①取少量原溶液,加入几滴酚酞试液
| 溶液变成红色
|
②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4
| 有无色气体产生,该气体遇空气变成红棕色
|
③取少量原溶液,加入BaCl2溶液
| 有白色沉淀生成
|
④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液
| 有白色沉淀生成
由此判断:
(1)溶液中肯定存在的离子是________________________,肯定不存在的离子是________________,可能存在的离子是________________。
(2)实验②中生成无色气体的离子方程式是________________________________。
(3)为进一步确定可能存在的阴离子,应该补充的实验设计是__________________。
参考答案:(8分)(1)Na+、CO32-、NO3-(2分,答对1-2
本题解析:
试题分析:根据实验①可知,溶液显碱性,这说明一定含有CO32-,则就一定没有Mg2+和Ba2+。由于溶液都是中性的,则一定含有钠离子。实验②有无色气体产生,该气体遇空气变成红棕色,这说明反应中生成的气体是NO,因此该反应是在酸性条件下铜和NO3-之间发生的氧化还原反应,即一定含有NO3-。实验③中生成的白色沉淀不一定是硫酸钡,因为反应中一定有碳酸钡白色沉淀生成,实验不能确定是否含有SO42-。实验④中生成的白色沉淀是氯化银,但由于在反应中加入了氯化钡,所以不能确定是否含有氯离子。要检验是否含有氯离
本题难度:一般
3、选择题 下列各溶液中一定能大量共存的微粒是

A.常温下,水电离c(H+)= 10—14mol/L的溶液中,Na+、NO3--、Al(OH)4--、CO32--
B.加入Al能产生气泡的溶液中:Fe2+、NO3 --、NH4+、Cl-- --、NH4+、Cl--
C.含有大量Al3+的溶液 中:Mg2+、Ba2+、F--、I-- 中:Mg2+、Ba2+、F--、I--
D.加入石蕊变红的溶液中:Na+、K+、MnO4--、SO42--
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下列各组离子在溶液中能大量共存的是
A.Ba2+、C1-、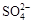 、K+ 、K+
B.Fe3+、OH-、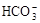 、Na+ 、Na+
C.Ca2+、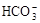 、C1-、K+ 、C1-、K+
D.Ag+、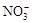 、Cl-、K+ 、Cl-、K+
参考答案:C
本题解析:A项Ba2+与SO42-反应生成BaSO4,B项Fe3+与OH-反应生成Fe(OH)3,C正确,D项Ag+与Cl-反应生成AgCl。
本题难度:一般
5、选择题 下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的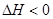
B.浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸
C.在等浓度NaCl和NaCrO4稀溶液中滴加AgNO3溶液,分析出AgCl,则KSP(AgCl)<KSP(Ag2CrO4)
D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
参考答案:AD
本题解析:A正确,因该反应的熵变小于0不利于自发,若能自发进行,则该反应的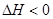 ;B错,苯酚的酸性比碳酸弱;C错,溶度积的关系为:KSP(AgCl)>KSP(Ag2CrO4);D正确; ;B错,苯酚的酸性比碳酸弱;C错,溶度积的关系为:KSP(AgCl)>KSP(Ag2CrO4);D正确;
本题难度:一般
|