微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于电解质溶液的叙述正确的是
A.常温下,Na2CO3溶液的pH>7
B.0.1mol/L Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是是放热反应
C.常温下.pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系为:
c(Cl-)=c(NH4+)>c(H+)=c(OH一)
D.常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
参考答案:AC
本题解析:
试题分析:A、由于CO32-发生水解:CO32—+H2O HCO3—+OH—,溶液显碱性,正确;B、说明水解是吸热的,错误;C、NH4Cl完全电离为NH4+和Cl-,加少量的氨水抑制NH4+的水解,由电荷守恒式: c(NH4+)+c(H+)=c(OH一) +c(Cl-)变形可得:c(Cl-)=c(NH4+
HCO3—+OH—,溶液显碱性,正确;B、说明水解是吸热的,错误;C、NH4Cl完全电离为NH4+和Cl-,加少量的氨水抑制NH4+的水解,由电荷守恒式: c(NH4+)+c(H+)=c(OH一) +c(Cl-)变形可得:c(Cl-)=c(NH4+
本题难度:一般
2、填空题 (12分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:

复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较强的物质。依照该规律,请判断下列反应不能成立的是????(填字母序号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CO2+H2O+NaClO===NaHCO3+HClO
C.CH3COOH+NaOH===CH3COONa+HCN
(2)根据上述信息判断,常温下浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是??(填序号),其pH为???(填数值);pH最大的是????(填序号)。
①HCN??②CH3COOH??③HClO4??④HClO??⑤H2SO4
(3)已知溶液积常数:KSP(AgI)=9.3×10-17,KSP(AgCl)=1.8×10-10,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是???????,其离子反应方程式为???????????。
参考答案:
 本题解析:
本题解析:
⑴不能成立的是A,由表中数据:酸性H2CO3>HClO>HCO3―,CO2+NaClO+H2O=NaHCO3+HClO;
⑵pH最小的是⑤(填序号),H2SO4是强酸,c(H+)= 0.05mol/L×2=0.1mol/L,其pH为1(填数值);HCN酸性最弱,pH最大的是①
⑶AgI溶解度小,白色固体转变为黄色,I―+AgCl 本题难度:简单
本题难度:简单
3、选择题 下列各组离子在给定条件下一定能够大量共存的是(????)
A.使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+
B.c(H+)=1.0×10-13 mol/L 的溶液中:Na+、SO42-、Al O2-、CO32-
C.加入铝粉后能产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42-
D.由水电离出c(H+)=10-12 mol·L-1的溶液:K+、Al3+、Cl-、SO42-
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列分子或离子在指定的溶液中一定能大量存在的是
A.常温下呈中性的溶液:Fe3+、Na+、Cl-、SO42-
B.1 mol/L的NaAlO2溶液:NH3?H2O、CO32-、K+、SiO32-
C.与铝单质反应产生氢气的溶液: Na+、K+、NO3-、Mg2+
D.由水电离出的c(H+)=1×10-12mol/L溶液:HCO3-、NO3-、Na+、Mg2+
参考答案:B
本题解析:
试题分析:A项中,由于Fe3+水解呈碱性,不能在中性溶液存在,A项错。C项中,与铝单质能反应产生氢的溶液为酸性或碱性,Mg2+在碱性溶液中不存在,C项错。D项中,水电离出的c(H+)=1×10-12mol/L的溶液为酸性或碱性,而HCO3-与H+、OH-都不能共存,Mg2+与OH-不能共存,D项错。
本题难度:一般
5、选择题 在t℃时,将a gNH3完全溶解于水,得V mL饱和溶液,测得该溶液的密度为ρg/cm3,质量分数为ω,其中n(NH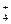 ) 为b mol。则下列叙述中错误的是?(???)
) 为b mol。则下列叙述中错误的是?(???)
A.溶液中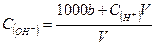 mol/L
mol/L
B.溶质的物质的量浓度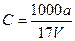 mol/L
mol/L
C.溶质的质量分数: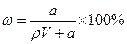
D.上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5ω
参考答案:C
本题解析:略
本题难度:一般