微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)镁是一种很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中利用镁制取硅的反应为2Mg+SiO2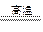 2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si
2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si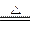 Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。
Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。
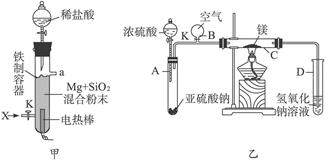
(1)图(甲)是进行Mg与SiO2反应的实验装置。
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的________________。
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物。其理由是_____________________________;当反应引发后,切断电源,反应能继续进行,其原因是_____________________________。
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知____________________在空气中能自燃。
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为______________________。
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是_______________________________。
Ⅲ.C中全部反应产物有___________、___________、___________(填化学式)。
参考答案:(1)Ⅰ.③? Ⅱ.防止加热条件下H2与空气混合爆炸,Mg与
本题解析:(1)镁加热时与N2、CO2都会反应,故选H2作为保护气,加热条件下H2与空气混合易发生爆炸,必须先通入H2排净空气后再加热,Mg与SiO2的反应是放热反应,引发后不需再加热,反应也能继续进行。Mg2Si遇盐酸迅速反应生成SiH4(硅烷),在空气中能自燃。(2)根据题给信息:玻璃中含有一定量的二氧化硅,可发生:2Mg+SiO2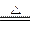 本题难度:简单
本题难度:简单
2、填空题 胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。
(1)三硅酸镁的氧化物形式为____________,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为____________。
(2)铝元素的原子核外共有________种不同运动状态的电子、__________种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径________(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
________________________
(4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是____________。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
参考答案:(1)2MgO·3SiO2·nH2O;1s22s1;
本题解析:
本题难度:一般
3、选择题 铝有较强的抗腐蚀性能,主要是因为( )
A.与氧气在常温下不反应
B.铝性质不活泼
C.铝表面形成了一层致密的氧化膜
D.铝耐酸耐碱
参考答案:通常情况下铝很耐腐蚀,这是因为铝在常温下与空气中的氧气发生化
本题解析:
本题难度:简单
4、选择题 下列说法错误的是[???? ]
A.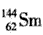 与
与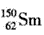 是同一种核素
是同一种核素
B.Al、Al2O3、Al(OH)3都可溶于NaOH溶液和盐酸中
C.甲烷燃烧放热,表明反应物的总能量大于生成物的总能量
D.向豆浆中加入硫酸钙制豆腐,是利用了胶体聚沉的性质
参考答案:A
本题解析:
本题难度:一般
5、推断题 由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
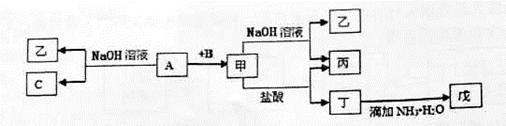
(1)写出下列物质的化学式:乙_______、丁_______、戊_______
(2)写出甲物质在工业上的一种主要用途:_______
(3)写出甲→乙+丙反应的离子方程式:____________
A→乙+C反应的化学方程式______________
参考答案:
(1)乙? NaAlO2;丁 AlCl3?; 戊?
本题解析:
试题分析:地壳中含量最多的金属元素是Al,故A为Al。A与NaOH反应生成NaAlO2和H2,故C为H2,乙为NaAlO2。A与B反应生成的甲可以和NaOH、盐酸反应,则B为O2,甲为Al2O3,则丙为H2O,丁为AlCl3,戊为Al(OH)3。Al2O3可用作耐火材料。
本题难度:一般