微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的转化在给定条件下能实现的是
①Fe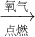 Fe2O3
Fe2O3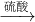 Fe2(SO4)3
Fe2(SO4)3
②SiO2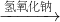 Na2SiO3
Na2SiO3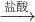 H2SiO3
H2SiO3
③AlCl3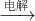 Al
Al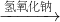 NaAlO2
NaAlO2
④Na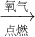 Na2O
Na2O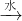 NaOH
NaOH
⑤SO2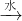 H2SO3
H2SO3 H2SO4.
H2SO4.
A.①⑤
B.②③
C.②⑤
D.③④
参考答案:C
本题解析:分析:①铁和氧气反应生成四氧化三铁;
②二氧化硅和氢氧化钠反应生成硅酸钠和水,硅酸钠和盐酸反应生成硅酸和氯化钠;
③氯化铝固体是共价化合物,无法电解;
④钠和氧气在点燃的条件下,生成过氧化钠;
⑤二氧化硫和水反应生成亚硫酸,亚硫酸和氧气反应生成硫酸;
解答:①铁和氧气反应3Fe+2O2 Fe3O4,得不到Fe2O3,故①错误;
Fe3O4,得不到Fe2O3,故①错误;
②二氧化硅和氢氧化钠反应2NaOH+SiO2═Na2SiO3+H2O,硅酸钠和盐酸反应Na2SiO3+2HCl=H2SiO3↓+2NaCl,故②正确;
③氯化铝固体是共价化合物,由分子构成,无离子,无法电解,所以得不到铝,故③错误;
④钠和氧气在点燃的条件下,生成过氧化钠:2Na+O2 Na2O2,得不到氧化钠,故④错误;
Na2O2,得不到氧化钠,故④错误;
⑤二氧化硫和水反应SO2+H2O?H2SO3,亚硫酸和氧气反应2H2SO3+O2═2H2SO4,故⑤正确;
故选C.
点评:本题考查了元素化合物的性质,熟悉相关的化学反应的方程式是解答的关键,题目较简单.
本题难度:一般
2、填空题 I、某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
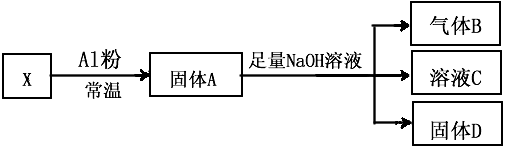
(1)生成气体B的化学方程式是____________________________。
(2)将固体D投入过量稀硫酸并充分反应后,过滤,再向滤液加入双氧水,得黄色溶液。 写出当加入双氧水时溶液中发生反应的离子方程式:________________________ 。
(3)若已知固体X的质量为7.2g反应中Al粉的质量是2.7g,气体B在标准状况下的体积为672mL,则固体D的质量是____________ g.
II、混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(4)若向其中一包加入100mL 3mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200mL 2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应:____________________________;
②混合物A中NaHCO3的质量为____________________g。
(5)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的
Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
参考答案:(1)2Al+2NaOH+2H2O==2NaAlO2+3H2
本题解析:
本题难度:一般
3、选择题 实验室用Al2(SO4)3制取Al(OH)3,最合适的试剂是
A.NaOH
B.H2SO4
C.NH3?H2O
D.KOH
参考答案:C
本题解析:
试题分析:其中B选项硫酸无法制取Al(OH)3。而A和D都是强碱,无论是多加还是少加都无法使铝离子完全沉淀,因此难以控制添加碱的量。而C选项只需氨水过量,就能使铝离子完全沉淀,故答案选C。3。
点评:本题关键在于分析氢氧化铝的两性,所以在制取时不能使用强碱。
本题难度:一般
4、填空题 某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤
| 实验现象
|
①将打磨过的铝片(过量)放入一定浓度的CuCl?2溶液中。
| 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。
|
②反应结束后分离出溶液备用。
| ?
|
③红色固体用蒸馏水洗涤后,置于潮湿空气中。
| 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。
?
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体????????????????????????????????????????????????;
③一段时间后固体由红色变为绿色??????????????????????????????????????。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是????????????????????????????????????????????????????????????????????????????。
解释此现象的离子方程式是???????????????????????????、????????????????????????????????。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
???????????????????????????????????????????????????????????????????。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是???????????????????????????????????????????????????????????????????。
参考答案:(1)①2Al+3Cu2+=2Al3++3Cu??????③
本题解析:
试题分析:(1)①置换反应就是一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,该反应为置换反应,所以本题答案为:2Al+3CuCl2=3Cu+2AlCl3;
③化合反应就是由两种或两种以上的物质生成一种其他物质的化学反应,红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为化合反应,所以本题答案为:2Cu+O2+CO2+H2O=Cu2(O
本题难度:一般
5、填空题 锌酸(H2ZnO2)盐不同于铝酸(H3AlO3)盐,锌酸盐稳定存在,如锌酸钠(Na2ZnO2)铝酸盐则不稳定,极易转化为偏铝酸盐,如铝酸对应的盐是偏铝酸钠(NaAlO2),而非铝酸钠(Na3AlO3)。
(1)ZnO类似于Al2O3,也是两性氧化物,试完成:
①Al2O3与NaOH(aq)的反应:____________________;
②ZnO与NaOH(aq)的反应:____________________。
(2)Zn(OH)2类似Al(OH)3,也是两性氢氧化物,试完成:
①Al(OH)3与NaOH(aq)的反应:____________________;
②Zn(OH)2与NaOH(aq)的反应:____________________。
(3)以上4个反应中,有没有氧化还原反应?若有,指出氧化剂和还原剂;若没有,说明理由。
(4)以上4个反应是不是离子反应?若是,请写出反应的离子方程式;若不是,请说明理由。
参考答案:(1)2NaOH+Al2O3══2NaAlO2+H2O
本题解析:(1)Al2O3与NaOH(aq)发生反应:2NaOH+Al2O3══2NaAlO2+H2O
ZnO为两性氧化物,推知其对应盐为Na2ZnO2,则:2NaOH+ZnO══Na2ZnO2+H2O
(2)Zn(OH)2类似Al(OH)3,也是两性氢氧化物,则:
NaOH+H3AlO3══2H2O+NaAlO2或NaOH+Al(OH)3══NaAlO2+2H2O
2NaOH+H2ZnO2══Na2ZnO2+2H2O或2NaOH+Zn(OH)2══Na2ZnO2+2H2O
(3)上
本题难度:一般
|