微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于pH=12的Na2CO3溶液说法正确的是
A.升高溶液温度,溶液pH增大
B.c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-)
C.溶液中c(OH-)>c(HCO3-)> c(H+)
D.2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
参考答案:AC
本题解析:
试题分析:碳酸钠是强碱弱酸盐,少部分碳酸根离子能够水解,即CO32—+H2O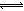 HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O
HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O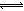 HCO3—+OH—,HCO3—+H2O
HCO3—+OH—,HCO3—+H2O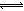 H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
考点:考查水溶液中粒子浓度大小关系,涉及酸与盐溶液中电荷守恒关系式、溶液pH、水的离子积、电离平衡移动、溶液的酸碱性、盐与盐溶液中物料守恒关系式等。
本题难度:困难
2、选择题 下列溶液中有关物质的量浓度关系错误的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) ="=" 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
参考答案:D
本题解析:
试题分析:pH=2的HA溶液与pH=12的MOH溶液以任意比混合,溶液都不显电性,由电荷守恒可知,c(H+)+c(M+)=c(OH-)+c(A-),A项正确;B.酸越弱,盐的水解程度越大,相同浓度时pH的关系为NaOH>Na2CO3>CH3COONa,则pH相同时的浓度关系为c(NaOH)<c(Na2CO3)<c(CH3COONa),B项正确;物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,由物料守恒可知2c(Na+)=c(CH3COO-)+c(CH3COOH),由电荷守恒可知c(CH3COO-)+c(OH-)=c(H+)+c(Na+)二者联式可得c(CH3COO-)+2c(OH-)
本题难度:困难
3、填空题 (8分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者 后者(填“>,<或=”)
参考答案:(1)> (2)碱 CH3COO
本题解析:
试题分析:(1)醋酸是弱酸,在加水稀释100倍时,醋酸继续电离,溶液的PH小于4,而盐酸是强酸,稀释100倍后,溶液的PH=4,所以稀释后溶液的PH:盐酸大于醋酸;
(2)醋酸和NaOH的物质的量相等,恰好反应生成强碱弱酸盐,溶液呈碱性,原因为CH3COO-水解打破了水的电离平衡所致,离子方程式为:CH3COO-+H2O CH3COOH+OH-;
CH3COOH+OH-;
(3)某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),说明溶液呈酸性,且溶液的电离程度大于水解程度,所以溶质有CH3COOH和CH3COONa;
(4)根据Ka的大小可知,,Ka(HNO2)> Ka(CH3COOH),根据电离平衡常数越大,酸性越强,所以HNO2酸性大于醋酸,pH相等的CH3COOH和HNO2,醋酸的浓度大于亚硝酸,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:醋酸大于亚硝酸。
考点:考查PH的大小比较,溶液的酸碱性,离子浓度的大小比较等知识。
本题难度:困难
4、选择题 在0.1 mol·L-1的NH4HSO4溶液中,下列微粒的物质的量浓度关系不正确的是 ( )
A.c(H+)>c(SO42-)>c(NH4+)
B.c(NH4+)+c(H+)=2c(SO42-)+c(OH-)
C.c(H+)=c(NH4+)+c(NH3·H2O)+c(OH-)
D.室温下滴加NaOH溶液至中性后:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
参考答案:C
本题解析:A项,c(H+)>c(SO42-)>c(NH4+),正确;B项,符合电荷守恒;C项,NH4HSO4=NH4++H++SO42-,NH4++H2O NH3·H2O+H+,H2O
NH3·H2O+H+,H2O H++OH-,所以c(H+)=c(NH4+)+2c(NH3·H2O)+c(OH-),错误;D项,当NaOH和NH4HSO4等浓度等体积混合后,此时溶液显酸性,所以加入的NaOH应大于NH4HSO4,所以该选项正确。
H++OH-,所以c(H+)=c(NH4+)+2c(NH3·H2O)+c(OH-),错误;D项,当NaOH和NH4HSO4等浓度等体积混合后,此时溶液显酸性,所以加入的NaOH应大于NH4HSO4,所以该选项正确。
本题难度:一般
5、填空题 室温下,0.1mol/L的醋酸溶液的PH约为3,当向其中加入醋酸钠晶体溶解后发现溶液的PH变大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大,因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的PH增大。
(1)上述解释中 (填“甲”或“乙”)正确。
(2)为验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸中加入少量下列物质中的_____,然后测定溶液的PH值。
A.固体CH3COOK
B.固体CH3COONH4
C.NH3气体
D.固体NaHCO3
(3) 若_____(填“甲”或“乙”)的解释正确,溶液的PH应_____(填“增大”、“减小”或“不变”)
(4)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有 种粒子
②溶液中有两种粒子的物质的量之和一定等于0.01mol,它们是 和
③溶液中n(CH3COO-)+ n(OH-)-n(H+)=
参考答案:(1)乙⑵ B ⑶乙、增大 ⑷① 7&#
本题解析:
(1)(2)(3)由题意知,溶液中存在两个平衡:CH3COOH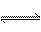 CH3COO-+H+,CH3COO-+H2O
CH3COO-+H+,CH3COO-+H2O CH3COOH+OH-。醋酸溶液中加入醋酸钠晶体,溶液的pH虽然增大,但只会小于7。因此CH3COOH的电离平衡占主导地位,乙同学的解释正确。为了验证两种解释哪种正确,就得选择一种含有CH3COO-但水解不显碱性的物质再实验,它只能是CH3COONH4。
CH3COOH+OH-。醋酸溶液中加入醋酸钠晶体,溶液的pH虽然增大,但只会小于7。因此CH3COOH的电离平衡占主导地位,乙同学的解释正确。为了验证两种解释哪种正确,就得选择一种含有CH3COO-但水解不显碱性的物质再实验,它只能是CH3COONH4。
(4)混合溶液中存在反应有:CH3COONa+HCl====NaCl+CH3COOH,NaCl====Na++Cl-,
CH3COOH CH3COO-+H+,H2O=====H++OH-。因此,溶液中存在Na+、Cl-、CH3COOH、CH3COO-、H2O、H+、OH-等7种粒子。根据物料守恒,n(CH3COOH)+n(CH3COO-)=n(Na+)=0.010mol,根据电荷守恒,n(CH3COO-)+c(OH-)+c(Cl)-=n(Na+)+n(H+),因此,n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。
CH3COO-+H+,H2O=====H++OH-。因此,溶液中存在Na+、Cl-、CH3COOH、CH3COO-、H2O、H+、OH-等7种粒子。根据物料守恒,n(CH3COOH)+n(CH3COO-)=n(Na+)=0.010mol,根据电荷守恒,n(CH3COO-)+c(OH-)+c(Cl)-=n(Na+)+n(H+),因此,n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。
本题难度:一般