微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图示与对应的叙述相符的是
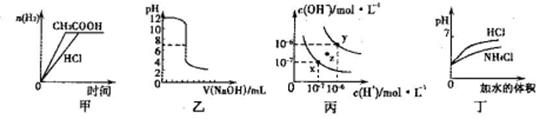
A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化
B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线
C.丙为水的电离曲线,从z点刭x点,可采用在水中加入适量NaOH固体的方法
D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化
参考答案:D
本题解析:
试题分析:A、醋酸是弱酸,盐酸是强酸,因此在物质的量浓度相同的情况下,盐酸与镁反应的反应速率快,A不正确;B、乙应该表示的是将稀盐酸滴人到0.01mol·L-lNaOH溶液中的滴定曲线,B不正确;C、丙为水的电离曲线,从z点刭x点,水的离子积常数减小,因此不能采用在水中加入适量NaOH固体的方法实现,C不正确;D、盐酸是强酸,完全电离,氯化铵是强酸弱碱盐,NH4+水解溶液显酸性。因此在pH相同的条件下分别稀释相同倍数时,盐酸的pH变化大,D正确,答案选D。
本题难度:简单
2、填空题 I.在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断

A.
B.
C.
D. E.
(1)升温,达到新的平衡的是???????? (2)降压,达到新的平衡的是????
(3)减少C的量,移向新平衡的是?????????(4)增加A的量,移向新平衡的是????
(5)使用催化剂,达到平衡的是????
II. CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下
平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
蓝色?????????????????黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴????????????????????????????????????????⑵??????????????
参考答案:I(1)B(2)C(3)E(4)A(5)D
II?⑴?
本题解析:
试题分析:I(1)该反应是放热反应,所以升高温度,平衡向逆反应方向移动,则答案选B。
(2)该反应是体积减小的可逆反应,则降低压强平衡向逆反应方向移动,所以大小C。
(3)减少C的量,平衡向正反应方向移动,答案选E。
(4)增加A的量,平衡向正反应方向移动,答案选A。
(5)使用催化剂,平衡不移动,答案选D。
II.根据方程式可知,欲使溶液由黄色变成黄绿色或蓝色,则应该使平衡向逆反应方向移动,则可采取的措施是加硝酸银溶液或加水稀释。
点评:该题是基础性试题的考查
本题难度:一般
3、选择题 四个体积相同的密闭容器中,在一定条件下发生反应:N2+3H2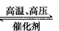 2NH3,反应开始时,反应速率最大的是[???? ]
2NH3,反应开始时,反应速率最大的是[???? ]
温度(℃)??
N2 (mol)
H2(mol)
?催化剂
A.
500
2
6
有
B.
500??
1.5
4.5
无
C.
450?
1.5
4.5
无
D.
450??
2
6
无
参考答案:A
本题解析:
本题难度:一般
4、实验题 (9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:

(1)写出铝片与盐酸、硫酸反应的离子方程式??????????????????????????????????
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是????????????????????????????????????????????????????????????
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,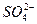 对该反应不影响。
对该反应不影响。
假设二:????????????????????????????????????????????????????????????。
假设三:????????????????????????????????????????????????????????????。]
假设四:????????????????????????????????????????????????????????????。
③?请你以“假设一”为实验课题,设计实验方案探究,要求写 出主要实验步骤。
出主要实验步骤。
????????????????????????????????????????????????????????????????????
??????????????????????????????????????????????????????????????????
???????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????
参考答案:
 本题解析:本题属于开放性试题,要求学生结合具体的实验情境,作出推断和假设,设问角度新颖,考查学生了解科学研究的基本思路和方法。(3)中答案也可能多种多样。如“
本题解析:本题属于开放性试题,要求学生结合具体的实验情境,作出推断和假设,设问角度新颖,考查学生了解科学研究的基本思路和方法。(3)中答案也可能多种多样。如“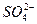 对金属铝与H+反应有抑制作用”或“
对金属铝与H+反应有抑制作用”或“ 本题难度:一般
本题难度:一般
5、填空题 (12分)控制变量法是研究化学变化规
参考答案:
本题解析:
本题难度:一般