微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
A.v (O2)= 0.01mol·(L·s)–1
B.v (NO)= 0.005mol·(L·s)–1
C.v (H2O)= 0.003mol·(L·s)–1
D.v (NH3)= 0.02mol·(L·s)–1
参考答案:C
本题解析:
试题分析:反应速率通常用单位时间内浓度的饱变化量来表示,则NO的反应速率是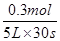 =0.002mol·(L·s)–1。又因为反应速率之比是相应的化学计量数之比,则氧气、氨气、水蒸气的反应速率分别是0.0025mol·(L·s)–1、0.002mol·(L·s)–1、0.003mol·(L·s)–1,答案选C。<
=0.002mol·(L·s)–1。又因为反应速率之比是相应的化学计量数之比,则氧气、氨气、水蒸气的反应速率分别是0.0025mol·(L·s)–1、0.002mol·(L·s)–1、0.003mol·(L·s)–1,答案选C。<
本题难度:一般
2、选择题 一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器
编号
| 温度(℃)
| 起始物质的量(mol)
| 平衡物质的量(mol)
|
CH3OH(g)
| CH3OCH3(g)
| H2O(g)
|
I
| 387
| 0.20
| 0.080
| 0.080
|
Ⅱ
| 387
| 0.40
| ?
| ?
|
Ⅲ
| 207
| 0.20
| 0.090
| 0.090
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
参考答案:AD
本题解析:
试题分析:A、容器I与容器Ⅲ相比甲醇的起始物质的量相等,但温度不同,温度较低时生成物的物质的量多,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,A正确;B、反应前后体积不变,因此容器Ⅱ与容器I相比平衡等效,因此达到平衡时,容器I中的CH3OH体积分数和容器Ⅱ中的相等, B不正确;C、容器I中温度高,反应速率快,因此容器I中反应达到平衡所需时间比容器Ⅲ中的少,C不正确;D、根据容器I表中数据可知,平衡时生成物的浓度均是0.080mol/L,则根据反应的化学方程式可知消耗甲醇的浓度是0.1
本题难度:一般
3、选择题 在锌粒与盐酸反应中,改变下列条件不能加快反应速率的是
A.升高反应温度
B.增大盐酸的浓度
C.将小锌粒换成大锌粒
D.在盐酸中滴入几滴CuSO4溶液
参考答案:C
本题解析:
试题分析:升高温度、增大氢离子的浓度可以加快反应速率。C中减小固体反应物的表面积,反应速率降低。D中加入硫酸铜,锌可以置换出铜,从而构成原电池,加快反应速率,答案选C。
考点:考查外界条件对反应速率的影响
点评:该题是高考中的常见题型,属于基础性试题的考查。主要是考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确外界条件是如何影响反应速率的,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 下列四个数据都表示合成氨的反应速率,N2+3H2 2NH3,其中代表同一条件下的反应速率的是 2NH3,其中代表同一条件下的反应速率的是
①v(N2)=0.03 mol·L-1·min-1??????????????????????②v(NH3)=0.09 mol·L-1·min-1
③v(H2)=0.045 mol·L-1·min-1????????????????????④v(H2)=0.135 mol·L-1·min-1
A.①②
B.①③
C.③④
D.②④
参考答案:D
本题解析:因为速率之比是相应的化学计量数之比,所以如果都用氢气表示其反应速率,则①②分别是0.09 mol·L-1·min-1、0.135 mol·L-1·min-1。所以②③相同,即答案选D。
本题难度:简单
5、选择题 在一定条件下的密闭容器中,进行反应:2SO2(g)+O2(g)  2SO3(g) 。下列有关说法正确的是???(???) 2SO3(g) 。下列有关说法正确的是???(???)
A.催化剂的使用可实现SO2的转化率为100%
B.达到化学平衡时,各物质的浓度不再改变
C.其他条件不变,升高温度,不能增大反应的速率
D.其他条件不变,降低SO3的浓度,可以增大反应的速率
参考答案:B
本题解析:催化剂改变的是反应速率,不能改变限度,A不正确。平衡时,各种物质的浓度是不变的,B正确。升高温度一定增大反应速率,C不正确。降低浓度,反应速率会减小,D不正确。答案选B。
本题难度:简单
|