微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一定温度下,在一个容积为2L的密闭容器中,二氧化硫和氧气发生如下反应:2SO2 + O2 = 3SO3,△H= -196.6 kJ/mol 在反应进行至10 min和20 min时,改变了影响反应的一个条件,反应进程如图所示。

(1)前10 min,正反应速率的变化趋势是________ (填“增大”、“减小”或“不变”)。前15 min,平均反应速率用SO3浓度变化可表示为 __________________。
(2)在如图所示的反应进程中,表示正反应速率与逆反应速率相等的时间段是____。
(3)据图判断:10 min时改变的反应条件可能是____(填写编号,下同);20 min时改变的反应条件可能是____。
a.加入催化剂
b.缩小容器体积
c.降低温度
d.增加O2的物质的量
参考答案:(1)减小;0.04/15 mol/(L·min)
本题解析:
本题难度:一般
2、选择题 在一体积不变的密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?2C(g);△H<0.达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
| X | Y
①
A的加入量
B的转化率
②
C的加入量
A的体积分数
③
再加入He气
A的转化率
④
升高温度
混合气体密度
A.①
B.②
C.③
D.④
参考答案:①增加A的物质的量,A的浓度增大,平衡向正反应方向移动,则B
本题解析:
本题难度:简单
3、选择题 对于可逆反应,当确知其平衡向正反应方向移动时,下列说法中正确的是[???? ]
A.生成物的产量一定增大
B.生成物 的质量分数一定增大
C.生成物的浓度一定增大
D.反应物的转化率一定增大
参考答案:A
本题解析:
本题难度:一般
4、填空题 已知,常温下1体积水能溶解2体积氯气,并且氯水中有如下平衡:Cl2 + H2O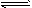 HCl + HClO HCl + HClO
(1)常温下,在一个体积为100mL的透明玻璃针筒里吸入80mL氯气后,再吸进10mL水,振荡后静置。写出针筒中观察到的现象是_____________________。
(2)将上述针筒长时间放置,又能看到何种变化__________;试用平衡观点加以解释__________。
参考答案:(1)气体体积缩小,溶液呈浅黄绿色
(2)气体体积继
本题解析:
本题难度:一般
5、填空题 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2。已知还原1molNO约放出451.7kJ的热量(同时生成气态水),则该反应的热化学方程式为_______________?。
(2)全钒氧化还原液流电池,是目前发展势头强劲的优秀绿色环保储能电池。其电池总反应为:?V3++VO2++H2O VO2++?2H++V2+。充电过程中,H+向?___________?迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。 VO2++?2H++V2+。充电过程中,H+向?___________?迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为_____________。
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)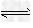 ?N2(g)+2CO2(g);△H<0。???? ?N2(g)+2CO2(g);△H<0。????
①?该反应的化学平衡常数表达式为K=___________?。
②若在一定温度下,将2molNO、1molCO充入1L 固定容积的容器中,反应过程中各物质的浓度变化如图所示。
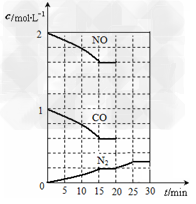
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将________移动(填“向左”、“向右”或“不”)。????????????????????
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是?_____________(填序号)。
A.加入催化剂 ???????B.降低温度 ? ?C.缩小容器体积 ?????D.增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+?+?O2+?4H+?=?4Fe3+?+?2H2O,则另一反应的离子方程式为______________?。
参考答案:(1)4NH3(g)+6NO?(g)=5N2(g)?+6H2
本题解析:
本题难度:一般
|