微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验原理,方法和结论都正确的是( )
A.某钠盐溶液中加入硝酸无明显现象,再加入氯化钡溶液有白色沉淀,该钠盐一定是硫酸钠
B.在硫酸钡中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
C.新制氯水中加入碳酸钙粉末搅拌,过滤、滤液中c(HClO)将增大
D.相同质量的两份锌粒分别加入足量稀硫酸,在一份中加入少量CuSO4?5H2O,其反应速率将加快,且最终产生的H2与另一份相同
参考答案:C
本题解析:
本题难度:一般
2、实验题 某学习小组用下图装置测定铝美合金中铝的质量分数和铝的相对原子质量
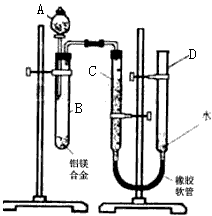
(1)A中试剂为__________
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是__________
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂;
⑤检查气密性,上述操作的顺序是__________;(填序号)记录C的液面位置时,除视线平视外,还应
__________________。
(4)B中发生反应的化学方程式为____________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为__________
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将__________(填“偏大”、“偏小”、“不受影响”)
参考答案:(1)NaOH溶液.
(2)除去铝镁合金表面的氧化膜.
本题解析:
本题难度:一般
3、简答题 全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因.
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为______.
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
浓硫酸
加热
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是______(填答案编号).

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是______、______(填答案编号).
a.浓硫酸b.澄清的石灰水c.氢氧化钠溶液d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)______.
③E装置的作用是______,上述装置最后尾气处理的方法是______.
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=______.
⑤在本实验中,下列情况会使测定结果n偏大的是______(填答案编号).
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3?nH2O.
参考答案:(1)钢铁发生吸氧腐蚀,负极是铁失电子生成亚铁离子,电极反应
本题解析:
本题难度:一般
4、选择题 下列实验操作和数据记录都正确的是? [???? ]
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2 g
B.用50mL酸式滴定管量取KOH溶液,体积为36.60 mL
C.用湿润的pH试纸测稀盐酸溶液的pH,pH=3.52
D.用10mL量筒粗略量取NaCl溶液,体积为9.2 mL
参考答案:D
本题解析:
本题难度:简单
5、填空题 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
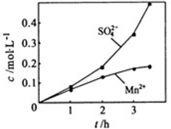
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳作用______.
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是______.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①______;②______;③检验SO42-是否被洗涤除去;④______;⑤低于100℃干燥.
Ⅱ锌铝合金的主要成分有Zn、Al、Cu、Si等元素.实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于
250mL容量瓶中.
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,
用0.01100mol?L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL.
(1)判断步骤②滴定终点的方法是______.
(2)计算合金中Cu的质量分数______.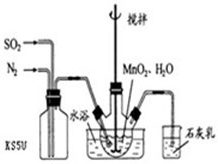
参考答案:Ⅰ(1)①石灰乳与氯气发生反应:2Ca(OH)2+2Cl2=
本题解析:
本题难度:一般