微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某课外实验小组设计的下列实验不合理的是 [???? ]
A. 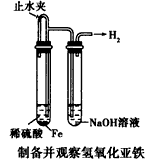
B. 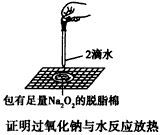
C. 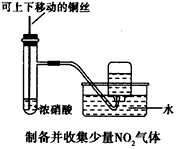
D. 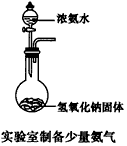
参考答案:C
本题解析:
本题难度:一般
2、选择题 现有一工业纯碱样品(含少量氯化钠等不与酸反应的杂质),用如图装置测定样品中碳酸钠的质量分数,其中正确的是 [???? ]
A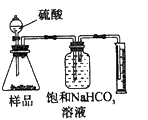
B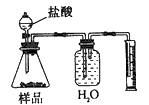
C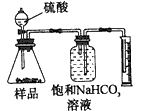
D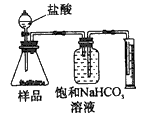
参考答案:C
本题解析:
本题难度:简单
3、简答题 高氯酸按(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NaClO4?(aq)+NH4Cl(aq)
?90℃?
.
?
NH4ClO4?(aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是______.
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见图1).从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)______干燥.

(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图2所示(加热和仪器固定装代已略去),实验步骤如下:
步骤1:按图2所示组装仪器,检查装置气密性.
步骤2:准确称取样品a ?g(约?0.5g)于蒸馏烧瓶中,加入约150mL水溶解.
步骤3:准确量取40.00mL约0.1mol?L-?H2SO4 溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20mL ?3mol?L-?NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c?mol?L-?NaOH标准溶液滴定至终点,消耗NaOH标准溶液v1mL
步骤8:将实验步骤1-7重复2次
①步骤3中,准确量取40.00mlH2SO4溶液的玻璃仪器是______.
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是______(填写步骤号).
③为获得样品中NH4ClO4的含量,还需补充的实验是______.
参考答案:(1)氨气与浓盐酸反应放出热量,反应需要温度较低,故NH4C
本题解析:
本题难度:一般
4、选择题 用下列装置能达到有关实验目的的是
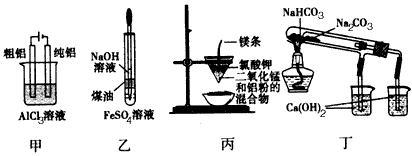 [???? ] [???? ]
A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)3
C.丙图装置可制得金属锰
D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
参考答案:C
本题解析:
本题难度:一般
5、填空题 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
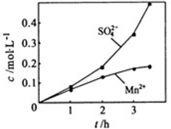
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳作用______.
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是______.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①______;②______;③检验SO42-是否被洗涤除去;④______;⑤低于100℃干燥.
Ⅱ锌铝合金的主要成分有Zn、Al、Cu、Si等元素.实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于
250mL容量瓶中.
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,
用0.01100mol?L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL.
(1)判断步骤②滴定终点的方法是______.
(2)计算合金中Cu的质量分数______.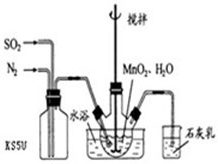
参考答案:Ⅰ(1)①石灰乳与氯气发生反应:2Ca(OH)2+2Cl2=
本题解析:
本题难度:一般
|