微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是 。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为 mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为 。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为 。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴 溶液为指示剂,滴定的终点现象为 。
参考答案:(14分)
(1)Ag2CrO4>AgCl&g
本题解析:
试题分析:
(1)根据Ksp进行计算,可以得到Ag+浓度大小关系,混合后c(Ag+)=1×10-4mol/L,Ksp=c2(Ag+)c(CrO42-),从而求出c(CrO42-)=2.0×10-4mol/L,故Na2CrO4浓度为4.0×10- 4mol/L。
(2)黄色转化为橙色,是铬酸根转化为重铬酸根,用重铬酸钠来鉴别,是应为NaNO2具有较强的还原性,可以与重铬酸根发生氧化还原反应,根据氧化还原反应基本原理可以写出化学方程式。
(3)阳极发生氧化反应,因为使用铁做电解,为活性电极,优先放电,故Fe-2e-=Fe2+;二价铁具有还原性,可将重铬酸根还原,生成三价铬,然后转化为氢氧化铬沉淀。
(4)根据上面数据可以看出,氯离子先与铬酸根与银离子产生沉淀,故可以用重铬酸根或铬酸根,氯离子沉淀完全,生成砖红色沉淀。
考点:考查沉淀溶解平衡、电解以及滴定等知识。
本题难度:困难
2、选择题 用两支惰性电极插入500mL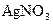 溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
A.54mg
B.81mg
C.108mg
D.216mg
参考答案:A
本题解析:略
本题难度:一般
3、选择题 某同学按下图所示的装置进行电解实验。下列说法正确( )
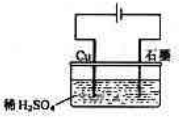
A.电解过程中,铜电极上有H2产生
B.电解过程中,铜电极不断溶解
C.电解过程中,石墨电极上始终有铜析出
D.整个电解过程中,H+的浓度不断增大
参考答案:B
本题解析:Cu和电源的正极相连,所以Cu做阳极,并失电子变成铜离子,阳极反应:Cu-2e-=Cu2+;石墨和电源的负极相连,做阴极,溶液中的氢离子得电子变成氢气,阴极反应:H++2e-=H2↑,所以正确的答案选B。
本题难度:一般
4、填空题 某课外化学兴趣小组设计了如图所示装置(虚框内部分未画出),在装置内起初发生的反应为: ? Cu+H2SO4===H2↑+CuSO4
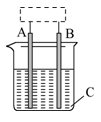
(1)该装置的名称是________.
(2)A、B中至少有一种是金属________,接________.
(3)C溶液中含有________.
参考答案:(1)电解池
(2)铜 ;电源的正极
(3)
本题解析:
本题难度:一般
5、填空题 日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:

请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成 的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为 。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 。
(4)饮用水中的NO3- 主要来自于NH4+。已知在微生物作用下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
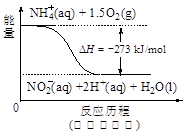
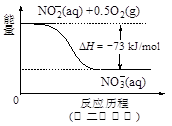
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
(5)固体a熔融电解时阴极反应式为
参考答案:(1)铝(或Al)(2分)
(2)①10Al+6NO3
本题解析:
试题分析:(1)由于铝能和酸或碱都能反应,该方案在调节pH时,若pH过大或过小都会造成铝(或Al) 的利用率降低。(2)①铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3
本题难度:困难