微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,下列说法正确的是[???? ]
A.阴极反应式为:Cu2++2e-==Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.阴极先是Fe3+放电,后Cu2+放电
D.阴极上不可能析出铜
参考答案:C
本题解析:
本题难度:一般
2、简答题 (12分)D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 周期 族。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示) 用石墨做电极电解该化合物的水溶液,则阴极反应式为 ,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式 (用元素符号表示)。该反应中还原剂是 。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:① B(s)+O2(g)=BO2(g);△H=-296.8kJ/mol②2BO2(g)+O2(g)  2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
参考答案:(1)第三周期第ⅦA族;
本题解析:
试题分析:根据题意可知这几种元素分别是:A是Na;B是S;C是Cl;D是O。(1)Cl元素在周期表中的位置是位于第三周期第ⅦA族;(2)A、B元素形成的常见化合物Na2S是强碱弱酸盐,弱酸根离子水解使水溶液显碱性。水解的两种方程式为:S2-+H2O HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.
HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.
考点:考查元素的推断、盐的水解、电解原理的应用、还原剂的判断、热化学方程式的书写的知识。
本题难度:一般
3、选择题 下列反应一定属于氧化反应的是
A.失电子的反应
B.原电池的正极反应
C.放热反应
D.电镀池镀件一极的反应
参考答案:A
本题解析:
试题分析:失电子的反应一定为氧化反应,A正确;原电池的正极反应、电镀池镀件一极的反应一定得电子属于还原反应B、D错误;放热反应与是否发生氧化还原反应无直接关系,C错误。
考点:氧化还原反应的判断
本题难度:一般
4、填空题 (12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶 液。
肼—空气燃料电池放电时:正极的电极反应式是 。
负极的电极反应式是 。
(3)下图是一个电化学过程示意图。

①锌片上发生的电极反应是 。
②假设使用肼 空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼 空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方
程式是 。
参考答案:(12分,每空2分)
(1)N2H4(1)+O2(g)
本题解析:
试题分析:(1)32.0gN2H4的物质的量是1mol,所以1molN2H4完全燃烧生成氮气和液态水放出的热量是624kJ,则N2H4完全燃烧反应的热化学方程式是N2H4(1)+O2(g) N2(g)+2H2O(l) △H=-624.0kJ/mol;
(2)燃料电池中正极发生还原反应,元素的化合价降低,所以是氧气发生还原反应,结合电解质溶液,正极反应的电极反应式为O2 +4e-+2H2O 4OH-,负极则是燃料发生反应,根据(1)判断N2H4的氧化产物是氮气,所以负极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(3)①该装置是电解池装置,Zn是阴极,发生还原反应,所以是铜离子得电子发生还原反应,电极反应式为Cu2++2 e- Cu;
②铜片作阳极,发生氧化反应,所以Cu片逐渐溶解,质量减少128g,即Cu的物质的量减少2mol,失去电子4mol,根据整个过程满足得失电子守恒规律,所以氧气得电子的物质的量也是4mol,根据O2 +4e-+2H2O 4OH-,得需要氧气得物质的量是1mol,标准状况下的体积是22.4L,空气中氧气体积含量为20%,所以需要空气的体积是22.4L/20%=112L;
(4)NaClO氧化NH3,制得肼的稀溶液,则Cl元素被还原为氯离子,根据元素守恒,产物中还有水生成,离子方程式为ClO-+2NH3 N2H4+Cl-+H2O。
考点:考查热化学方程式的书写,电化学理论的应用
本题难度:一般
5、选择题 如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是
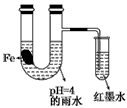
[???? ]
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-==4OH-
D.U型管中溶液pH逐渐减小
参考答案:C
本题解析:
本题难度:一般