微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的性质比较,不正确的是( )
A.碱性:NaOH>Mg(OH)2
B.金属性:K>Na
C.气态氢化物稳定性:HF>HCl>H2S
D.原子半径:Cl>S
参考答案:A.金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物
本题解析:
本题难度:简单
2、选择题 已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水。下列说法不正确的是 [???? ]
A.简单离子的半径:C>D>E>B ??????
B.工业上常用电解法制得C和D的单质
C.稳定性:A2B>A2E
D.单质D可用于冶炼某些难熔金属
参考答案:A
本题解析:
本题难度:一般
3、填空题 元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
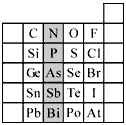
(1)阴影部分元素N在元素周期表中的位置为第_________周期第__________族。 根据元素周期律,预测:酸性强弱H3AsO4__________H3PO4。(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度
(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度___________。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
__________________________。
(4)下列说法正确的是_________________
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
参考答案:(1)二;ⅤA 族;<
(2)4;更小
(3)H
本题解析:
本题难度:一般
4、填空题 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
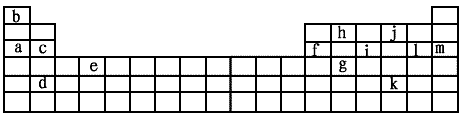
(1)下列___________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力
2.形成稳定结构的倾向下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1)
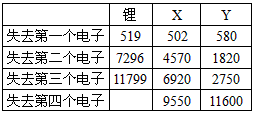
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。_________________________
②表中X可能为以上13种元素中的_________(填写字母)元素。用元素符号表示X和j形成化合物的化学式____________。
③Y是周期表中__________族元素。
④以上13种元素中,_____________(填写字母)元素原子失去核外第一个电子需要的能量最多。
参考答案:(1)①④
(2)①因为首先失去的电子是能量最高的电
本题解析:
本题难度:一般
5、选择题 碘单质及其化合物具有重要应用。下列说法正确的是[???? ]
A.从海带中提取的过程只发生物理变化
B. 互为同位素
互为同位素
C.加碘食盐能使淀粉溶液变蓝
D.从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2,再用酒精萃取
参考答案:B
本题解析:
本题难度:简单