微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是( )
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+)
C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,
溶液中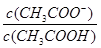 的值增大到原来的10倍
的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中:
c(Na+)=c(CH3COOH)>c(CH3COO—)>c(H+)=c(OH—)
参考答案:C
本题解析:
试题分析:A、根据质子守恒可得c(OH—)=c(H+) + c(HS—) + 2c(H2S),错误;B、HA的酸性未知,若为强酸,则存在c(Na+)=c(A—)>c(OH—)=c(H+),若为弱酸则有c(Na+)>c(A—)>c(OH—)>c(H+),错误;C、醋酸是弱酸,当溶液的pH从3.0升到4.0时,氢离子变为原来的0.1倍,根据电离平衡常数只随温度而变化的特点,所以K不变时,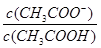 需增大到原来的10倍,才能保持K不变,正确;D、常温下pH=7的溶液为中性,所以c(H+)=c(OH—),根据电荷守恒得c(Na+)=c(CH3COO—),错误,答案选C。
需增大到原来的10倍,才能保持K不变,正确;D、常温下pH=7的溶液为中性,所以c(H+)=c(OH—),根据电荷守恒得c(Na+)=c(CH3COO—),错误,答案选C。
考点:考查溶液中离子浓度的比较,守恒规律的应用,电离平衡常数的应用
本题难度:困难
2、填空题 (10分)常温下,有下列7种溶液:A.Na2CO3 B.CH3COONa C.AlCl3
D.CH3COOH E.NaHCO3 F.NaOH G.HCl。
请回答有关问题:
(1)A溶液显碱性的离子方程式是: ;
(2)将C溶液蒸干灼烧后得到的固体是(写化学式): ;C与E是“泡沫灭火器”的药品,写出两溶液混合反应的离子方程式: ;
(3)若A、E两种溶液的pH相同,物质的量浓度大小关系是 。
(4)A、B、F溶液各25mL、物质的量浓度均为0.1mol/L,若分别加入25mL 0.1mol/L 的G溶液后,pH最大的是: 。(填“A、B或F”)
参考答案:(1)CO32-+H2O 本题解析:
本题解析:
试题分析:(1)碳酸钠溶液是强碱弱酸盐,显碱性,水解的离子方程式是:CO32-+H2O HCO3-+OH-;
HCO3-+OH-;
(2)AlCl3溶液中存在AlCl3 +3H2O Al(OH)3 + 3HCl,盐酸易挥发,蒸干过程中盐酸挥发,导致平衡右移,生成氢氧化铝,灼烧后得到的固体是氧化铝;AlCl3与NaHCO3水解相互促进,生成气体和沉淀,能够作泡沫灭火器的药品,两溶液混合反应的离子方程式:Al3++ 3HCO3- = Al(OH)3↓+3CO2↑;
Al(OH)3 + 3HCl,盐酸易挥发,蒸干过程中盐酸挥发,导致平衡右移,生成氢氧化铝,灼烧后得到的固体是氧化铝;AlCl3与NaHCO3水解相互促进,生成气体和沉淀,能够作泡沫灭火器的药品,两溶液混合反应的离子方程式:Al3++ 3HCO3- = Al(OH)3↓+3CO2↑;
(3)根据越弱越水解,Na2CO3与NaHCO3 ,碳酸钠的水解能力大于碳酸氢钠的水解能力,两种溶液的pH相同时,物质的量浓度大小关系是E>A 。
(4)Na2CO3、CH3COONa、NaOH溶液各25mL、物质的量浓度均为0.1mol/L,若分别加入25mL 0.1mol/L 的HCl溶液后,发生反应Na2CO3 +HCl=NaHCO3 +NaCl,碳酸氢钠溶液显碱性,CH3COONa+HCl=CH3COOH+NaCl,该混合溶液显酸性,NaOH+HCl=NaCl+H2O,溶液的显中性,pH最大的是A。
考点:考查盐类水解原理及应用,PH计算与大小比较等知识。
本题难度:一般
3、选择题 在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为
A.A>B
B.A=10-4B
C.B=10-4A
D.A=B
参考答案:B
本题解析:
试题分析:同题意可知,A=10-9mol·L-1,而B =10-5mol·L-1,因此选B
考点:考查酸碱盐对水的电离的影响。
本题难度:一般
4、选择题 将下列浓溶液蒸干并灼烧,可以得到原溶质的是
A.氯化钠
B.碳酸氢钠
C.偏铝酸钠
D.氯化铁
参考答案:AC
本题解析:
本题难度:困难
5、选择题 下列各溶液中CH3COO-的数量关系,正确的是
①0.1 mol·L-1 CH3COOH溶液25 mL
②0.05 mol·L-1 CH3COOH溶液50 mL
③0.1 mol·L-1 CH3COONa溶液25 mL
④0.05 mol·L-1 CH3COONa溶液50 mL
A.①<②<③<④
B.①<②<④<③
C.④<③<②<①
D.③<④<①<②
参考答案:B
本题解析:本题利用弱电解质电离与盐的水解比较溶液中离子浓度.首先将4个选项的溶液分成2组,①②中是CH3COOH溶液,只能电离出少量的CH3COO-,两溶液n(CH3COOH)相等.②溶液浓度小,电离程度大,因此②>①.③④中是CH3COONa溶液,两溶液中完全电离出CH3COO-,n(CH3COO-)相等.④溶液浓度小,水解程度大,剩余的CH3COO-较少.
本题难度:困难