微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应为_____________????????_,若反应过程中转移了2mol电子,可产生水的质量为???????g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,.其中c(Na+)=" 3" c(Cu2+ )=" 0.3" mol/L,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(已折算到标准状况)气体。此时氢氧燃料电池外电路中转移电子的物质的量为???????mol。(不考虑电路中的其它损耗)。
参考答案:(1)O2 + 4H+ + 4e- = 2H2O ;18 ;
本题解析:(1)在燃料电池中正极通入的是氧气,所以正极反应式为O2 + 4H+ + 4e- = 2H2O。因为总反应是O2 + 2H2 = 2H2O,反应中转移的电子是4mol,所以若反应过程中转移了2mol电子,可产生水的质量为18g。
(2)在阴极上首先是铜离子放电,析出铜,然后是氢离子放电,生成氢气。铜离子是0.1mol/L×0.1L=0.01mol,得到的电子是0.02mol。氢气是 本题难度:一般
本题难度:一般
2、选择题 发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是[???? ]
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O+2NH4Cl(s)===BaCl2(aq)+ 2NH3·H2O(l)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
参考答案:D
本题解析:
本题难度:一般
3、选择题 在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
A.正极附近SO42-浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极反应式为Zn-2e-=Zn2+
D.该原电池工作过程中电解质溶液的pH增大
参考答案:D
本题解析:负极生成Zn2+,SO42-向负极迁移,A错误;电子通过导线由锌片流向铜片,B错误;C中是负极反应式,C错误;随着硫酸的消耗,溶液的pH增大,D正确。
本题难度:一般
4、选择题 下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜
C.把铜片插入三氯化铁溶液,在铜片表面析出铁
D.把锌放入稀盐酸中,加几滴氯化铜溶液,产生气泡速率加快
参考答案:C
本题解析:
试题分析:A.把铜片和铁片紧靠在一起浸入稀硫酸中,则构成原电池,铁是负极,铜是正极,正确;B.电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,正确;C.铁离子具有氧化性,能把铜氧化,但还原产物是亚铁离子,错误;D.锌能置换出铜,从而构成原电池,加快反应速率,D正确;选C。
考点:考查原电池。
本题难度:一般
5、选择题 下列装置中,属于原电池的是? ( )
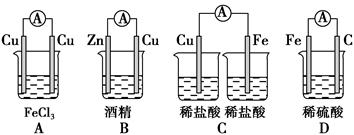
参考答案:D
本题解析:
试题分析:利用组成原电池的条件分析,A项两电极相同;B项酒精为非电解质;C项缺少盐桥;只有D项符合。
本题难度:一般