微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液。若Cl2与KOH溶液反应时,被还原与被氧化的氯元素物质的量之比是11
参考答案:
本题解析:
本题难度:一般
2、选择题 下列各组物质在适宜的条件下反应,其中氧化剂与还原剂物质的量之比为1:1的是
A.F2 + H2O
B.Li + O2(条件点燃)
C.CO2+Mg
D.NO2+H2O
参考答案:A
本题解析:
正确答案:A
氧化剂与还原剂物质的量之比A、1:1;B、1:4;C、1:2;D、2:1
本题难度:一般
3、选择题 24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )。
A.+2
B.+3
C.+4
D.+5
参考答案:B
本题解析:题目中指出被还原的元素是Cr,则得电子的物质必是K2Cr2O7,失电子的物质一定是Na2SO3,其中S元素的化合价从+4→+6;而Cr元素的化合价将从+6→+n(设化合价为n)。根据氧化还原反应中得失电子守恒规律,有0.05 mol·L-1×0.024 L×(6-4)=0.02 mol·L-1×0.020 L×2×(6-n),解得n=3。
本题难度:一般
4、选择题 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是
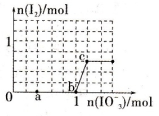
A.还原性:HSO3->I-,氧化性:IO3->I2>SO42-
B.a点处的氧化产物是SO42-,还原产物是I-
C.当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol
D.若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O
参考答案:C
本题解析:
试题分析:根据图像可知开始阶段没有碘生成,这说明首先发生的反应应该是IO3-+3HSO3-=I-+3SO42-+3H+。在氧化还原反应中还原剂的还原性强于还原产物的还原性,因此还原性HSO-3>I-;继续加入KIO3,出现单质碘,这说明此时发生的反应为IO3-+6H++5I-=3H2O+3I2。在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,因此氧化性IO3->I2。则 A、根据以上分析可知还原性:HSO3->I-,氧化性:IO3->I2>SO42-,A正确;B、a点处亚硫酸氢钠过量,则氧化产物是SO42-,还原产物是I-,B正确;C、3mol亚硫酸氢钠最多消耗1mol碘酸钾,产生1mol碘离子,但碘酸钾可以氧化碘离子,所以当溶液中的I-为0.4mol时,加入的KIO3不一定为0.4mol,C错误;D、根据以上分析可知若向KIO3溶液中滴加NaHSO3溶液,碘酸钾过量,可以生成单质碘,因此反应开始时的离子方程式为2IO3-+5HSO3-=I2+5SO42-+3H++H2O,D正确,答案选C。
考点:考查离子反应、氧化还原反应的有关判断与计算
本题难度:困难
5、选择题 有关化学用语正确的是
A.乙烯的最简式C2H4
B.四氯化碳的电子式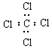
C.乙炔的结构简式CHCH
D.甲苯的 分子式C7H8
分子式C7H8
参考答案:D
本题解析:略
本题难度:一般