微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语的理解中正确的是
A.电子式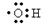 :可以表示羟基,也可以表示氢氧根离子
:可以表示羟基,也可以表示氢氧根离子
B.结构示意图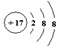 :可以表示氯原子,也可以表示氯离子
:可以表示氯原子,也可以表示氯离子
C.比例模型 :可以表示水分子,也可以表示二氧化硫分子
:可以表示水分子,也可以表示二氧化硫分子
D.结构简式(CH3)2CHOH:可以表示1—丙醇,也可以表示2—丙醇
参考答案:C
本题解析:略
本题难度:一般
2、选择题 在过量的稀硫酸溶液中加入5.6g铁粉,待反应完全后,再加入50 mL 0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:__FeSO4+__KNO3+__H2SO4===__K2SO4+__Fe2(SO4)3+__NxOy+__H2O,则对该反应的下列说法正确的是( )。
A.反应中还原产物是NO
B.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
C.反应过程中转移的电子数为8e-
D.氧化产物和还原产物的物质的量之比为1∶4
参考答案:B
本题解析:
试题分析:n(Fe)=0.1mol,所以n(FeSO4)=0.1mol;在反应中失去电子0.1mol,n(KNO3)=" 0.050" L ×0.5mol/L=0.025mol,根据电子转移数目相等可知在反应中N原子得到的电子是0.1mol÷0.025mol=4,所以反应后N的化合价为+1价,因此反应后N2O,选项A错误;根据氧化还原反应中电子守恒及化学反应在的元素守恒可得方程式是8FeSO4+2KNO3+5 H2SO4==K2SO4+4 Fe2(SO4)3+N2O+5H2O,所以选项B正确;在反应过程中转移的电子数为0.1NAe-,选项C错误;在该反应在氧化产物Fe2(SO4)3和还原产物N2O的物质的量之比为4∶1,错误。
考点:考查氧化还原反应的配平、电子转移、概念等知识。
本题难度:一般
3、选择题 下列各电子式中正确的是??
A.氯原子
B.氟原子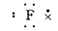
C.溴化钡
D.硫化钾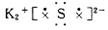
参考答案:A
本题解析:氟原子最外层含有7个电子,电子式为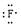 。溴化钡是离子化合物,形成的化学键是离子键,电子式为
。溴化钡是离子化合物,形成的化学键是离子键,电子式为 。硫化钾是离子化合物,电子式
。硫化钾是离子化合物,电子式
本题难度:一般
4、选择题 对于反应:TiCl4+4Na=4NaCl+Ti,下列说法正确的是
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.Ti是氧化剂
D.TiCl4是还原剂
参考答案:A
本题解析:
试题分析:在TiCl4+4Na=4NaCl+Ti反应中,Na是还原剂,TiCl4是氧化剂,该反应只能在熔融状态下进行,水溶液中,钠与水反应,所以A正确。
本题难度:一般
5、选择题 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见下图。下列说法不正确的是
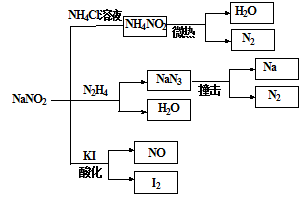
A.NH4NO2的热稳定性大于NaNO2
B.NaN3分解,每产生1molN2转移6mole-
C.NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3—互为等电子体
D.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2
参考答案:AB
本题解析:
试题分析:A、由图中可知NH4NO2微热即可分解,稳定性较差,所以NH4NO2稳定性小于NaNO2,A错误;B、NaN3分解,每产生1molN2转移2/3mole-,B错误;C.NaNH2与N2O反应生成NaN3,N2O与N3—互为等电子体,C正确;D、NaNO2在酸性条件下与碘化钾反应生成碘单质,淀粉遇碘单质变蓝,所以可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2,D正确;选AB。
考点:考查氧化还原反应的基本概念、电子转移、反应条件等知识。
本题难度:一般