反应器中有绿色晶体,g瓶有黄绿色气体
?
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是?????????。
②第二次实验,g瓶有红棕色的烟,其原因是??????????????????????。
(5)第三次实验得到的固体,最可能含有微量杂质是??????????????????,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是???????????????????????。
参考答案:(1)2KMnO4+16HCl=2KCl+2MnCl2+5C
本题解析:
?
?试题分析:在实验室中在常温下一般用高锰酸钾溶液和浓盐酸发生反应来制取氯气。反应的方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。(2)由于浓HCl有挥发性,而且反应是在溶液中制取的,所以氯气中含有杂质HCl和水蒸气。在d装置中用饱和的食盐水来除去HCl;在装置e盛装有浓硫酸来对氯气进行干燥。f、g的作用是作为安全瓶来防止倒吸现象的发生。(3)①纯净铁粉与氯气在500℃左右反应制取FeCl2。化学反应方程式为Fe+Cl2 FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点: FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点:
本题难度:一般
2、填空题 (10分)榴石矿石可以看作 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下: 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
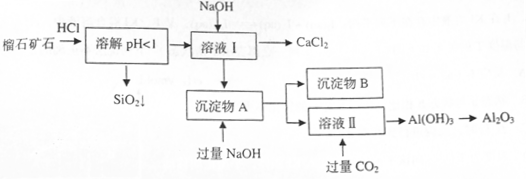
(1)榴石矿加盐酸溶解后,溶液里除了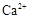 外,还含有的金属离子是????????。 外,还含有的金属离子是????????。
(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致????????????溶解,???????沉淀。

(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式??????????????????。
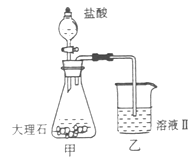
(4)①某同学在实验室中用图I装置制取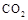 气体并通入溶液II中,结果没有沉淀产生,可能的原是???????????;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为???????????????。 气体并通入溶液II中,结果没有沉淀产生,可能的原是???????????;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为???????????????。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系???????????????????????????。
参考答案:(10分)
(1) 本题解析:(1)榴石矿加盐酸后溶液中金属离子有:Ca2+、Fe3+、AL3+,SiO2不溶于盐酸; 本题解析:(1)榴石矿加盐酸后溶液中金属离子有:Ca2+、Fe3+、AL3+,SiO2不溶于盐酸;
(2)向溶液I中加入NaOH溶液,NaOH不能过量,若NaOH过量可能会导致AL(OH)3溶解,氢氧化铝为典型的两性氢氧化物,同时可能会生成Ca(OH)2沉淀。控制溶液PH=9~10的目的是使Fe3+、AL3+变为沉淀,而Ca2+则不能生成沉淀。
(3)写出向沉淀物A中加入过量氢氧化钠溶液,其中氢氧化铝会与氢氧化钠溶液反应,而氢氧化铁沉淀则不溶于氢氧化钠溶液。其反应的离子方程式为: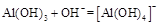 或AL(OH)3+OH—=ALO2—+2H2O; 或AL(OH)3+OH—=ALO2—+2H2O;
(4)①大理石与稀盐酸反应生成的二氧化碳气体中混有HCL、水蒸气等杂质气体,要使澄清石灰水能变浑浊只需将二氧化碳气体中的HCL气体除去,可将混合气体通入盛有饱和碳酸氢钠的洗气瓶中。
②石灰水变浑浊是生成了碳酸钙,其溶解平衡表达式为:CaCO3(s)?Ca2+(aq)+2OH—(aq)
本题难度:简单
3、选择题 用一种试剂鉴别苯酚溶液、己烯、碘化钾溶液、苯四种液体,可选用(???)
A.盐酸
B.FeCl3溶液
C.溴水
D.四氯化碳
参考答案:C
本题解析:
试题分析:加入溴水,在苯酚溶液中会出现白色沉淀,在己烯中溴水会褪色,在碘化钾溶液中会颜色加深,在苯中会出现分层,上层是橙红色,下层是无色,可以鉴别。
点评:有机物的鉴别要充分考虑有机物的物理性质,颜色、密度、熔沸点,还要考虑化学性质。
本题难度:简单
4、选择题 右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
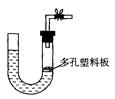 ? ?
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔
参考答案:B
本题解析:大理石和稀硫酸反应生成硫酸钙微溶,附着在大理石表面,阻止大理石和稀硫酸反应,不能制取CO2,A不正确。制取氯气需要加热,C不正确。电石能溶于水,不能满足随开随用、随关随停,D不正确。锌是固体,不溶于水,和稀硫酸反应不需要加热,B正确,所以答案选B。
本题难度:一般
5、实验题 下图是实验室中制备气体或验证气体性质的装置图
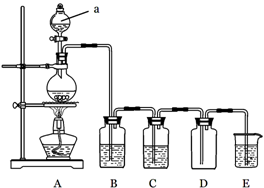
(1)仪器a的名称是???????????????。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为??????????????????????????????????????。
②装置B中的溶液为???????????????;烧杯中溶液的作用为?????????????????。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是?????,现象是?????????????????????????????????;
②证明SO2具有还原性的现象是?????????????????????????????????????????????;
③证明生成气体中含有CO2的现象是?????????????????????????????????????????;
④D装置的作用是?????????????????????????????????????。
参考答案:(1)?分液漏斗
(2)①?? MnO2+4H++2C
本题解析:(2)生成的氯气中会混有氯化氢和水蒸气,应先除杂,再干燥,故B中用饱和NaCl溶液除氯化氢,C用来干燥氯气,D用来收集氯气,E用来吸收多余的氯气,因氯气有毒,会污染环境
(3)①A中产生的气体为SO2 CO2的混合物,其中只有SO2能使品红褪色,故B装置能验证SO2的漂白性;②同理,只有SO2能表现出还原性,与酸性高锰酸钾溶液反应,而CO2不能;③证明生成气体中含有CO2,要先除掉SO2,因SO2也能使石灰水变浑浊,所以现象是D中品红不褪色且石灰水变浑浊,故D装置的作用是检验SO2是否除尽
本题难度:一般
|