96.4
(4)检验滤液H中含有CO 的方法是___________________________________。 的方法是___________________________________。
(5)氯化钙结晶水合物(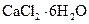 )是目前常用的无机储热材料,选择的依据是___________ )是目前常用的无机储热材料,选择的依据是___________ (填序号)。 (填序号)。
a.熔点较低(29℃熔化)? b.能导电? c.易溶于水? d.无毒
参考答案:(15分)
(1)2 本题解析:略 本题解析:略
本题难度:一般
2、填空题 (l)火法炼锌是将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,再把氧化锌和焦?炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来。
①写出火法炼锌的主要反应:
焙烧反应:????????????????????????????????????。
鼓风炉中可能发生的反应:?????????????????????(任写一个)
②从保护环境和充分利用原料角度看如何处理和利用产生的烟气?
??????????????????????????????????????????????????????????????????
(2)工业上冶炼铝就是电解氧化铝
①冶炼铝的电解槽中的阴极和阳极材料均用石油炼制和煤的干馏产品??????(填物质名称)
②氧化铝的熔点很高,在铝的冶炼中要加入冰晶石(Na3AlF),其作用是____??????????。
③工业上冶炼铝时用的原料是Al2O3,而不是AlCl3,其原因是???????????????????。
(3)工业上“联合制碱法”中主要反应的化学方程式是???????????????????????。其中的CO2来源于?????????????。
(4)磁酸钙是制玻璃的原料之一,工业上制玻璃是在玻璃熔炉中进行,其中反应之一为:
 ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为??????(用含a的代数式表示)。 ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为??????(用含a的代数式表示)。
参考答案:(1)① 2ZnS+3O2 本题解析:(1)①根据题意“将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌”反应的化学方程式为2ZnS+3O2 本题解析:(1)①根据题意“将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌”反应的化学方程式为2ZnS+3O2 2ZnO+2SO2;根据题意“再把氧化锌和焦?炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来”可能发生的反应就有:2C+O2 2ZnO+2SO2;根据题意“再把氧化锌和焦?炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来”可能发生的反应就有:2C+O2 本题难度:一般 本题难度:一般
3、填空题 用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
①浸泡海带:取海带500g,加13~15倍水量分两次浸泡,得浸出液6000mL左右,碘含量为0.5g/L。?
②碱化浸出液除褐藻糖胶:即海带浸出液1000mL,加入浓度为40% 的NaOH溶液,控制pH值为12左右,充分搅拌后使褐藻酸钠絮状沉淀而沉降。采用倾析法分离出清液。
③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
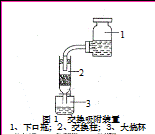
④交换吸附:氯型强碱性阴离子交换树脂(R—Cl表示)注入交换柱中(树脂层高度为12cm),如右图连接交换装置,待溶液全部通过后,树脂颜色变为黑红色。
⑤洗脱:分两步进行
第一步:取8~10% 的NaOH溶液40mL注入交换柱中。在强碱作用下,树脂颜色逐渐变浅,待树脂基本褪色后,放出溶液,收集于一小烧杯中为碱性洗脱液。????
第二步:取10% 的NaCl溶液40mL注入上述交换柱中。稍待一会儿,慢慢放出溶液收集于另一小烧瓶中,为氯化钠洗脱液。
⑥往碱性洗脱液中滴加H2SO4溶液(6mol/L),烧杯底部会析出一层泥状粗碘。
⑦往氯化钠洗脱液中滴加H2SO4溶液(6mol/L)使之酸化,再滴加10% 的NaNO2溶液(在通风橱中进行)。待溶液由无色转变为棕红色直至出现棕黑色浑浊。
⑧离心分离即得粗碘。
试回答下列问题
(1)步骤③在酸性条件下用NaClO(或H2O2)氧化碘的离子方程式:?? ? ?,
及I2 +I-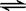 I3-。如何用化学方法检验有多碘离子生成?????????????????????。 I3-。如何用化学方法检验有多碘离子生成?????????????????????。
(2)第④步发生的离子反应为:????????????????????????????。
(3)步骤⑤洗脱时第一步发生的离子反应为(洗脱液中含有I-和IO3-离子):
???????????;第二步洗脱发生的离子反应为:?????????????????。
(4)步骤⑦发生反应的离子方程式为 ????????????????????????????????。
参考答案:
(1)2I-+ClO-+2H+ = I2+Cl-+H
本题解析:
本题考查用离子交换法从海带中提取碘。(1)NaClO(或H2O2)在酸性条件下有强氧化性,将I-氧化成I2;(2)离子交换的原理,根据颜色变化可知,I3-交换Cl-,方程式为R-Cl+I3-= R-I3+Cl- ;(3)在强碱作用下,树脂颜色逐渐变浅,根据洗脱液中含有I-和IO3-离子,说明R-I3转化为I-和IO3-,方程式为:3R-I3+6OH- = 3R-I+5I-+IO3-+3H2O;加入Cl-与I-交换,R-I+Cl- = R-Cl+I-;(4)在酸性条件下NO2-具有氧化性,将I-氧化
本题难度:一般
4、填空题 硝酸大量用于制造无机肥料,如硝酸铵、硝酸钙、硝酸磷肥,还广泛用于其他工业生产。硝酸工业生产流程图如下图所示:
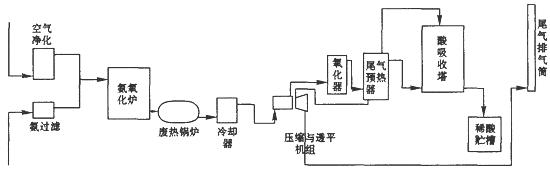
(1)第—步是氨的接触氧化,在一定温度下以铂铑网作为催化剂,写出该反应的化学方程式??????????。
(2)在吸收塔中用水循环吸收NO2得到硝酸,写出发生该反应的化学方程式??????????????????????,该过程是放热的,为了使吸收效果更好,在吸收过程中需要控制在???????????????????条件下。
(3)尾气中含有氮的氧化物,直接排放到空气中会危害环境,写出一项氮的氧化物可能引起的环境问题?????????????????。工业上常用纯碱溶液吸收NO2,生成亚硝酸盐、硝酸盐和其他物质,写出该反应的化学方程式??????????????????????。
参考答案:
(1)4NH3+5O2 本题解析: 本题解析:
试题分析:(1)氨气的催化氧化,反应方程式是:4NH3+5O2 4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO;?该反应是放热,低温促进反应正向移???动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3 4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO;?该反应是放热,低温促进反应正向移???动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3
本题难度:一般
5、选择题 化学与工农业生产和人类生活密切相关。下列说法中错误的是
A.晶体硅是良好的半导体材料,是信息技术的关键材料
B.开发利用风能、太阳能、生物质能等新能源符合“低碳经济”战略
C.海轮外壳上镶入锌块,可减缓船体的腐蚀
D.酸雨就是pH <7的雨水,主要是由大气中的SO2、NO2等造成的
参考答案:D
本题解析:略
本题难度:一般
|