微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图是一套实验室制气装置,能用于发生、干燥和收集的气体是 (?? )
(已知中间的广口瓶中装的是浓硫酸)
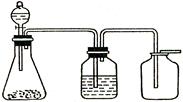
A.大理石和稀硫酸
B.二氧化锰和浓盐酸
C.铁和稀盐酸
D.过氧化钠和水
参考答案:D
本题解析:
试题分析:碳酸钙和稀硫酸反应生成硫酸钙,硫酸钙是微溶性物质,覆着在碳酸钙表面,是反应停止,不能用来制备CO2气体;二氧化锰和浓盐酸制备氯气需要加热;铁和盐酸反应生成氢气,但氢气的密度小于空气的,应该用向下排空气法收集。过氧化钠和水反应生成氧气,可用浓硫酸干燥,也可以用向上排空气法收集,所以正确的答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于培养向上规范严谨的实验设计能力。该题的关键是熟练记住常见气体的制备原理、装置、收集方法以及干燥、验满等,然后结合题意灵活运用即可。
本题难度:简单
2、实验题 甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g 、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称??????????????。
(2)检查A装置气密性的操作是??????????????????????????????????。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、硫酸、硫酸铵
| 反应的化学方程式为?????? ①??。
|
乙小组
| ②
| 浓氨水、氢氧化钠
| 用化学平衡原理分析氢氧化钠的作用:??????? ③?????。
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为????????????。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是??????????????????????????????。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是???????????????。
参考答案:(1)圆底烧瓶(2分)(2)连接导管,将导管插入水中,加热试
本题解析:(1)写出仪器a是圆底烧瓶。(2)检查A装置气密性的操作是将导管接入盛水的水槽中,用水握住试管,有气泡产生,放手后能形成一段稳定的水柱,说明气密性良好。(3)①氢氧化钙和硫酸铵共热生成硫酸钙和氨气,方程式为Ca(OH)2+(NH4)2SO4 CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O NH3·H2O NH3·H2O NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO 3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)] 3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)]
(5)洗气前装置D前后的质量差包含未参加反应的NH3,使得氢原子的物质的量增大,比值减小。要使没定值准确,只要找一种不吸收NH3的干燥剂即可,故可选用碱石灰。
【考点定位】本题通过NH3和氨气中N、H原子个数测定来考查化学实验基础知识,涉及到仪器的识别、气密性的检查、实验误差解释、相关计算、实验评价及设计。
本题难度:简单
3、填空题 三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒人蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
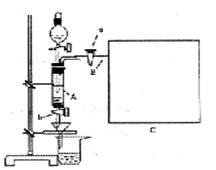
填写下列空白:
(1)如何检查装置A的气密性:???????????????????。
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与铁粉反应要快,其原因是?????????。
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由???????????????????。
(4)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成?????????。
(5)若要测废铁屑的纯度,可测出从B处放出气体的体积,测量气体体积时,需待气体冷却至室温时进行,现有下列装置测定从B处放出气体的体积(忽略导管在量筒中所占的体积),应选用?????????(填序号),理由是?????????。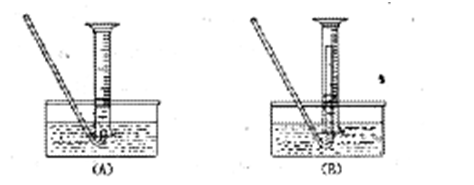
参考答案:(1)关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,
本题解析:
(1)检查气密性的操作,注意要叙述完整:关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,漏斗下端会形成一段液柱,一段时间后,若液柱缓缓下移,说明气密性不好,若液柱停止不动,则说明气密性好。(或关闭分液漏斗活塞和活塞b,打开活塞a,将管口B接一段带玻璃管的乳胶管井引入水槽中,用双手捂住装置A,若水槽中有气泡产生,放开双手玻璃管中形成一段液柱,则气密性良好。)
⑵原电池能加快某些氧化还原反应速率,所以:铁粉与杂质铜形成原电池反应,加快了反应速率。
⑶用直接蒸发,最后得到以Fe2O3为主的混合物,不用用直接蒸发的理由是:因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O晶体;
⑷双氧水或新制氯水等氧化剂,前者还原产物是水,后者生成氯化物;
⑸①B;防止气体冷却时发生倒吸现象。
本题难度:一般
4、选择题 下列气体有色的是
A.Cl2
B.NO
C.SO2
D.NH3
参考答案:A
本题解析:略
本题难度:一般
5、实验题 (15分)某研究小组用黄铜矿(主要成分是CuFeS2,其中S为-2价)为主要原料炼铜,其总反应为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。事实上该反应是按如下流程分步进行的:


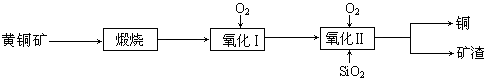
(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是?????(填化学式)。
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为?????。
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
沸腾炉温度/℃
| 560
| 580
| 600
| 620
| 640
| 660
| 水溶性Cu/%
| 90.12
| 91.24
| 93.50
| 92.38
| 89.96
| 84.23
| 酸溶性Cu/%
| 92.00
| 93.60
| 97.08
| 97.82
| 98.16
| 98.19
①CuFeS2与O2反应的化学方程式为?????。
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是?????。
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是?????。
④生成物冷却后的除铁的实验操作方法主要是?????。已知在溶液中,Cu2+开始沉淀和沉淀完全的pH分别为4.7、6.7,Fe3+开始沉淀和沉淀完全的pH分别为1.1、3.2;如果制得的硫酸铜溶液中含有少量的Fe3+,请写出除去溶液中Fe3+的实验操作步骤:?????。
参考答案:共15分
(1)FeSiO3(2分)
(2)4C
本题解析:
试题分析:(1)根据2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2,可得矿渣为FeSiO3;
(2)由题意可知,CuFeS2在酸性溶液中与氧气在一种细菌的作用下生成的硫酸盐是硫酸铜和硫酸铁,化学方程式为4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O; 4CuSO4+2Fe2(SO4)3+2H2O;
(3)①精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,最终得CuSO4·5H2O,说明铁元素的存在形式是氧化铁,加水溶解可过滤除去,所以CuFeS2与O2反应的化学方程式为4CuFeS2+15O2=4CuSO4+2Fe2O3+4SO2
②因为CuFeS2与O2反应放热,所以在生产过程中控制加入CuFeS2的速度,控制温度;
③水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少;
④生成物中除硫酸铜外还有氧化铁,氧化铁不溶于水,所以冷却后的除铁的实验操作方法主要是过滤;除去铁离子而不除去铜离子,调节溶液的pH值在3.2到4.7之间,使铁离子完全沉淀,而铜离子不沉淀,所以具体操作是加入CuO[或Cu(OH)2或CuCO3]粉末,充分搅拌,调节溶液的pH约为3.2,加热煮沸,过滤,用(适量)稀硫酸酸化。
本题难度:一般
|
|