微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列制备和收集气体的实验装置合理的是[???? ]
A.用氯化铵和氢氧化钙制取NH3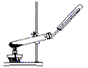
B.用铜片和稀硝酸制取NO 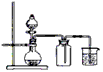
C.用锌粒和稀硫酸制取H2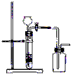
D.用双氧水和二氧化锰制取O2
参考答案:D
本题解析:
本题难度:简单
2、填空题 (8分)电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
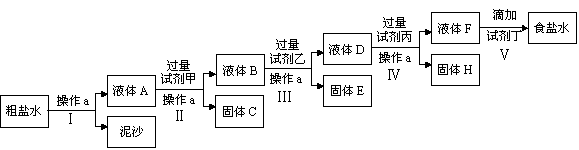 请回答以下问题:
请回答以下问题:
(1)操作a的名称是_______,所用玻璃仪器有_____________;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)___溶液;
(3)写出固体H所含物质的化学式_____________;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式
_______________________;_______________________。
参考答案:(8分)
(1)过滤; 玻璃棒、漏斗、烧杯(2分)
本题解析:略
本题难度:一般
3、实验题 实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。

(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是????????????。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为?????????mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果????????(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。
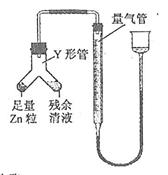
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将???转移到??中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是?????????????????????????(排除仪器和实验操作的影响因素)。
参考答案:(1)ACB(按序写出三项)??(2)①残余清液中,n(Cl
本题解析:(1)注意加药品时先加入固体MnO2,再通过分液漏斗加入浓盐酸,最后才能加热。
则依次顺序是ACB
(2)①根据反应的离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,可以看出反应残余液中c(Cl-)>c(H+),用甲方案测得的是c(Cl-),而不是(H+)。
Mn2++Cl2↑+2H2O,可以看出反应残余液中c(Cl-)>c(H+),用甲方案测得的是c(Cl-),而不是(H+)。
②根据c(盐酸)×V(盐酸)=c(氢氧化钠)×V(氢氧化钠),c(盐酸)=c(氢氧化钠)×V(氢氧化钠)/ V(盐酸)="22.00mL×0.1000" mol·L-1/20.00mL="0.1100" mol·L-1。
③由于KSP(MnCO3)<KSP(CaCO3),过量的CaCO3要转化为一部分MnCO3,由于M(MnCO3)>M(CaCO3),故最终剩余的固体质量增加,导致测得的c(H+)偏小。
④Zn与盐酸反应放热,因此,冷却后气体的体积将缩小。
本题难度:一般
4、选择题 下列关于实验室制取乙烯的实验,其中说法正确的是(???)
A.乙醇和浓硫酸体积比为3∶1
B.温度计应插入反应物液体中
C.加热混合液至140℃左右
D.向浓硫酸中注入乙醇
参考答案:B
本题解析:略
本题难度:简单
5、选择题 已知在一定条件下能发生下列反应:N2+3Mg═Mg3N2(固),空气缓缓通过下图装置时,依次除去的气体是( )
A.CO2、N2、H2O、O2
B.H2O、CO2、N2、O2
C.CO2、H2O、O2、N2
D.N2、O2、CO2、H2O
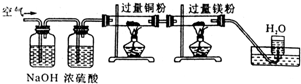
参考答案:空气中含有CO2、H2O、O2、N2等成分,氢氧化钠是碱性物
本题解析:
本题难度:简单