微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能够用于鉴别二氧化硫和二氧化碳的溶液是
A.澄清的石灰水
B.品红溶液
C.紫色石蕊试液
D.BaCl2溶液
参考答案:B
本题解析:试题分析:二氧化硫和二氧化碳都能使澄清的石灰水变混浊,A不正确;二氧化硫可以使品红溶液褪色,但二氧化碳不能,B正确;二者溶于水溶液都显酸性,都可以使紫色的石蕊试液变红色,C不正确;二者和氯化钡溶液都不反应,D不正确,答案选B。
考点:考查二氧化硫和二氧化碳的鉴别
点评:该题是中等难度的试题,也是高考中的常见考点,试题基础性强,难易适中,有助于培养学生的严谨的实验分析以及探究能力。该题的关键是熟练记住二者的性质差异,然后结合题意具体问题、具体分析即可。
本题难度:困难
2、选择题 用氯气跟单质化合不能制取的物质是
A.KCl
B.FeCl2
C.FeCl3
D.CuCl2
参考答案:B
本题解析:试题分析:铁在氯气中燃烧生成的氯化铁,得不到氯化亚铁,选项B不正确,其余选项都是正确的,答案选B。
考点:考查氯气和金属反应的产物判断
点评:该题是基础性试题的考查,难度不大。该题的关键是熟练记住金属单质和氯气的反应产物,属于识记性知识的检验。
本题难度:简单
3、选择题 下列叙述不正确的是
A.液氯泄漏事故时,附近人员应迅速远离液氯泄漏地点,并逆风往安全区域疏散
B.水的沸点比硫化氢高,主要原因是水分子间能形成氢键
C.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
参考答案:D
本题解析:分析:A.氯气有毒,如果顺风跑始终都在污染范围内;
B.O的非金属性较强,对应的氢化物含有氢键;
C.从沉淀的转化的角度分析;
D.铁和铝与浓硫酸在常温下钝化.
解答:A.氯气有毒,如果顺风跑始终都在污染范围内,如果逆风跑到上风区则比较安全,可脱离氯气的污染区,故A正确;
B.O的非金属性较强,水分子间能形成氢键,较一般分子间作用力强,沸点较高,故B正确;
C.AgBr比AgCl更难溶于水,在AgCl的饱和溶液中加入NaBr,可生成AgBr沉淀,故C正确;
D.铁和铝与浓硫酸在常温下可发生钝化,在固体的表面生成一层致密的氧化物膜,故D错误.
故选D.
点评:本题考查较为综合,题目难度中等,注意相关物质的性质,学习中注重基础知识的积累.
本题难度:困难
4、选择题 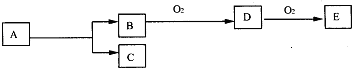 如图,B为常见金属或非金属单质,有下列转化关系:若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是
如图,B为常见金属或非金属单质,有下列转化关系:若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是
A.AlCl3
B.H2O2
C.KCl
D.NaCl
参考答案:D
本题解析:分析:可用作自来水消毒的气体C是Cl2,由氧化物D转化为氧化物E时,增加氧的质量约是D物质总质量的25.8%,可知D是Na2O,E是Na2O2,则B是Na,A是NaCl.
解答:可用作自来水消毒的气体C是Cl2,由氧化物D转化为氧化物E时,增加氧的质量约是D物质总质量的25.8%,
可知D是Na2O,E是Na2O2,存在: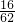 ×100%=25.8%,其转化过程为:NaCl
×100%=25.8%,其转化过程为:NaCl Na
Na Na2O
Na2O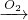 Na2O2,
Na2O2,
则B是Na,A是NaCl.
故选D.
点评:本题考查无机物的推断,题目难度中等,注意根据物质的物理特性作为推断的突破口,把握物质的性质以及相互之间的转化关系.
本题难度:一般
5、选择题  某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu(?NO3)2、HN03物质的量浓度之比为
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu(?NO3)2、HN03物质的量浓度之比为
A.1:1:1
B.1:3:1
C.2:1:4
D.1:1:4
参考答案:D
本题解析:分析:依据氧化还原反应的顺序规律分析计算,溶液中含有Fe?(NO3)?3、Cu?(NO3)?2、HNO3,氧化性顺序为HNO3>Fe?(NO3)?3>Cu?(NO3)?2,加入铁后依次反应.
解答:稀溶液中各物质的氧化性顺序为HNO3>Fe?(NO3)?3>Cu?(NO3)?2,加入铁后会依次发生氧化还原反应,
①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+;
从图象中可知铁为1mol时,无Fe2+生成,发生的反应是①消耗硝酸为4mol,生成Fe3+1mol;
再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;
再加入1mol铁发生反应③,此时又生成Fe2+物质的量为1mol,说明原溶液中Cu2+物质的量为1mol;
综上所述可知原溶液中Fe?(NO3)?3为1mol,Cu?(NO3)?2物质的量为1mol,HNO3物质的量为4mol,物质的量浓度之比为1:1:4;
故选D.
点评:本题考查了铁及其化合物的性质应用,主要考查氧化还原反应的顺序反应规律及计算应用.
本题难度:困难