微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用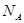 表示阿伏加德罗常数的值。下列叙述中不正确的是
表示阿伏加德罗常数的值。下列叙述中不正确的是
A.足量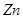 与一定量的浓硫酸反应,产生
与一定量的浓硫酸反应,产生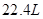 (标况)气体时,转移的电子数为
(标况)气体时,转移的电子数为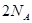
B.一定条件下,32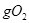 和足量的铁粉充分反应,转移的电子数为
和足量的铁粉充分反应,转移的电子数为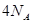
C.4.6g乙醇和甲酸(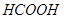 )的混合物中含有的碳原子数在
)的混合物中含有的碳原子数在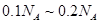 之间
之间
D.分子总数为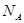 的NO和
的NO和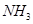 混合气体中含有的氮原子数为
混合气体中含有的氮原子数为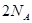
参考答案:D
本题解析:
试题分析:解答此类题目要注意(一)理清一套运算关系:n=N/NA=m/M=V/Vm=cV(aq)注意相关概念的理解(二)注意审题细节1、微粒种类2、气体摩尔体积适用条件3、物质的组成和结构写明相应化学式结构式4、物质间的反应理清相关反应及特点5、电离、水解。A、 足量Zn与一定量的浓硫酸发生的反应为2H2SO4(浓)+Zn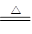 本题难度:一般
本题难度:一般
2、计算题 (6分)为了测定某铜银合金的组成,将30.0g 合金溶于 80.0mL 13.5mol/L 的浓硝酸中,待合金完全溶解后,收集到气体6.72L(标准状况下),并测得溶液中H+的物质的量浓度为1.00 mol/L ,假设反应后溶液的体积仍为80.0 mL。
计算:(1)被还原的硝酸的物质的量
(2)合金中银的质量分数
参考答案:0.300mol? 36%
本题解析:
解:设合金中Cu和Ag的物质的量分别为x和y
(1)被还原的硝酸的物质的量即为生成气体的物质的量
所以,被还原的硝酸的物质的量为6.72L/22.4mol?L-1 =" 0.300mol"
(2)参加反应的硝酸为(13.5mol/L-1.00mol/L)×0.08L =" 1.00" mol
64.0x + 108y = 30.0
2.00x + y = 1.00-0.300
解得:y = 0.100
所以银的质量分数为:0.100mol×108 g?
本题难度:简单
3、选择题 已知溶液中C(Na+)=0.2mol/L,C(Mg2+)=0.25mol/L,C(Cl-)=0.4mol/L,如果溶液中还有SO42-,那么C(SO42-)应为
A.0.1mol/L
B.0.3mol/L
C.0.15mol/L
D.0.5mol/L
参考答案:C
本题解析:根据溶液显电中性,即溶液中阳离子所带电荷总数与溶液中阴离子所带电荷总数相同,所以正确选项为C;
本题难度:一般
4、填空题 补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol?L-1、0.008mol?L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理
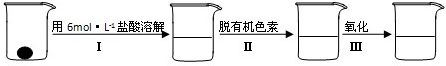
③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10mL
④比色,直到与选取的标准颜色一致或相近即可.
试回答下列问题:
(1)配制25mL0.01mol?L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:______,若配制过程中定容时俯视刻度会使配制的浓度______(填偏大、偏小、不影响).
(2)步骤②脱色过程包括加入:______(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→______(填操作).
(3)比色法确定待测液的浓度的原理是______
(4)已知有关离子的还原性顺序为I->Fe2+>SCN->Br->Cl-,则步骤②中Ⅲ可选择的氧化剂有______a.碘水??b.溴水???c.氯水??d.通入(SCN)2;写出加入上述某一氧化剂时涉及到的离子反应方程式:______
(5)若其补铁剂是由乳酸
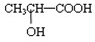
?与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:______.
参考答案:(1)反应操作步骤有量取、溶解、移液、洗涤、定容、摇匀等操作
本题解析:
本题难度:一般
5、填空题 12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 gCO2。测得有机化合物A的蒸气对H2的相对密度是30,求:

(1)有机物A的分子式 。
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为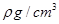 )的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
参考答案:(1)C3H8O(2分)
本题解析:
试题分析:(1)根据阿伏加德罗定律可知,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,则该化合物的相对分子质量为30×2=60,则12g有机物的物质的量是
12g÷60g/mol=0.2mol
n(H2O)=14.4g÷18/mol=0.8mol
n(CO2)=26.4g÷44/mol=0.6mol
所以12.0g有机物中含有:m(C)=0.6mol×12g/mol=7.2g
m(H)=2×0.8mol×1g/mol=1.6g
则m(O)==12.0g-7.2g-1.6g=3.2g
n(O)=3.2g÷16g/mol=0.2mol
所以有机物中含有:N(C)=3,N(H)=8,N(O)=1
则有机物分子式为C3H8O
(2)amL(密度为ρg/cm3)的有机物A的质量为:m=aρg
物质的量为:aρg÷60g/mol= mol
mol
量筒液面读数为bml,即生成氢气的体积为bml
则n(H2)=0.001bL÷22.4L/mol
则C3H8O+xNa C3H(8-x)ONa+0.5xH2
C3H(8-x)ONa+0.5xH2
1 0.5x
 mol
mol 
解之得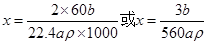
考点:考查有机物分子式的确定
点评:该题是基础性试题的考查,试题贴近教材,紧扣基础,有利于调动学生的学习兴趣和学习积极性,难度不大。该题的关键是根据原子守恒法来解答,有助于培养学生的规范答题能力。
本题难度:一般