微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)(1)若2.6g乙炔(C2H2气态)完全燃烧生成液态水和CO2时放热130kJ。则此反应的热化学方程式为:??????????????????????????????????????。
(2)图中铜板上铁铆钉处容易生锈,被腐蚀的金属是???????,负极的电极反应式为????????????

(3)氢气被公认为21世纪替代矿物燃料的理想能源,已知破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氧气中的化学键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。则1mol氢气燃烧放出的热量是???????????????????kJ
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,

请回答:
①氢氧燃料电池的能量转化主要形式是???????????????????????,在导线中电子流动方向为??????????????????(用a、b表示)。
②负极反应式为??????????????????????????????????????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
2、选择题 下图是模拟电化学反应的装置图。下列有关叙述中,错误的是
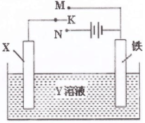
A.X为碳棒,Y为NaCl溶液,开关K置于N处,溶液中阳离子移向碳棒
B.X为锌棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,该法称为牺牲阳极的阴极保护法
C.X为铜棒,Y为CuSO4溶液,开关K置于M处,铜棒质量将增加,外电路中的电子流向铜棒
D.X为铜棒,Y为CuSO4溶液,开关K置于N处,铁棒质量将增加,溶液中Cu2+浓度不会改变
参考答案:AB
本题解析:
试题分析:开关置于N处时,X作电解NaCl溶液的阳极,铁作阴极,内电路中阳离子移向阴极,而非阳极,故A错误;外加电源的电解池中,锌棒作被腐蚀的阳极,铁是受保护的阴极,这就是外加电源的阴极保护法,而非牺牲阳极的阴极保护法,故B错误;开关K置于M处,铜棒作原电池的正极,铁作负极,则外电路中电子流向铜棒,内电路CuSO4溶液中的Cu2+移到正极上发生还原反应,析出单质铜覆盖在铜棒上,铜棒质量增加,故C正确;开关置于N处时,铜棒作阳极,反应为Cu-2eˉ==Cu2+,铁作阴极,CuSO4溶液中的Cu2+移
本题难度:一般
3、填空题 现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因。
(1)用CO2和氢气合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH、H2的燃烧热分别为—726.5kJ/mol、—285.8kJ/mol,写出工业上用CO2和H2合成CH3OH的热化学方程式:???????????????????????。
(2)用铂作电极,一极通入空气,一极通入CH3OH(l),与KOH溶液可组成燃料电池,其负极反应式为??????????????___。溶液中的阴离子向????????????极定向移动。
(3)如图是一个电化学装置示意图,用CH3OH—空气燃料电池作此装置的电源。
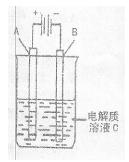
①如果A为粗铜,B为纯铜,C为CuSO4溶液。该原理的工业生产意义是??????。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液。通电后,
若B极增重10.8 g,该燃料电池理论上消耗____mol甲醇。(计算结果保留两位有效数字)
(4)常温下向1L、0.2 mol/L NaOH溶液中通入4.48 L(标准状况)的
SO2(忽略混合后溶液体积的变化),若测得溶液的pH<7,则溶液中c(SO32—)_??c(H2SO3)(填“>”、“<”、或“=”)。有关该溶液中离子浓度关系的判断正确的是?????????(填字母编号)。
A.c(S O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+)
O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+)
B.c(H2SO3)+c(HSO3—)+c(SO32—)=" 0.2" mol/L
C.c(H2SO3)+c(H+)=c(SO32—)十c(OH-)
D.c(Na+)>c(H+)>c(HSO3—)>c(OH—)
参考答案: 本题解析:略
本题解析:略
本题难度:一般
4、填空题 (10分)如图所示,常温,U形管内盛有100mL的溶液,请按要求回答下列问题。
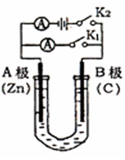
(1)若所盛溶液为CuSO4溶液,打开K2?,闭合K1,则:
A为?????极(填“正、负”),B极的电极反应式为???????????????????????????。
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,闭合K2,则:
①A电极可观察到的现象是??????????????????????????
②总反应的化学方程式是????????????????????????????
③反应一段时间后打开K2? ,若忽略溶液的体积变化和气体
的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,
将溶液充分混合,溶液的C(OH-)为????????????????????
参考答案:((10分)(1) ???
本题解析:(1)若所盛溶液为CuSO4溶液,打开K2?,闭合K1,即为原电池,由于锌更活泼,为原电池的负极,B极则为正极,其电极反应式为:Cu2++2e-?=? Cu;
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,闭合K2,即为电解池,B极为阳极,A极为阴极,A极现象为:产生气泡,溶液变红;总反应方程式为:2NaCl+2H2O通电 2NaOH+ H2↑+Cl2↑;反应一段时间后打开K2? ,若忽略溶液的体积变化和气体
的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,
将溶液充分
本题难度:一般
5、选择题 下列说法正确的是[???? ]
A.金属的腐蚀分为化学腐蚀和电化学腐蚀,但二者的本质不相同
B.向某溶液中通入Cl2,再滴加淀粉碘化钾溶液,变蓝色,则原溶液中一定含有I-
C.已知Ksp(BaCO3) > Ksp(BaSO4),则BaSO4不能向BaCO3转化
D.常温常压下33.6LCl2 与5.6gFe充分反应转移电子数为0.3 NA
参考答案:D
本题解析:
本题难度:一般