微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3 +3H2O中,H3BO 3的转化率(
B(OCH3)3 +3H2O中,H3BO 3的转化率(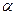 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是____?????????????????????????___
②该反应的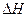 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(O
[B(O H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
参考答案:
(1) B2H6 + 6H2O=2H3BO3 +6H
本题解析:略
本题难度:简单
2、选择题 一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
A.正反应速率等于逆反应速率,且不等于零
B.X的浓度不再发生变化
C.Y的浓度不再发生变化
D.Z的浓度不再发生变化
参考答案:ABCD
本题解析:判断化学平衡的两个标志:正、逆反应速率相等,但不等于零(动态平衡),故A正确;
各组分浓度不变,故B、C、D正确;
本题难度:一般
3、选择题 在一定固定的密闭容器中,放入3mol X(g)和2mol Y(g),在一定条件下发生反应: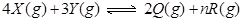 ,达平衡后,容器内温度不变,平衡后压强比原来增加5%,X的浓度减小,则该反应方程式中的n值是(???)
,达平衡后,容器内温度不变,平衡后压强比原来增加5%,X的浓度减小,则该反应方程式中的n值是(???)
A.3
B.4
C.5
D.6
参考答案:D
本题解析:由于压强是增大的,所以4+3<2+n,即n>5,所以答案选D。
本题难度:一般
4、填空题 .(10分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g) 4C(g),
4C(g),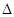 H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是??? __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是??? __
A.增加B的物质的量????? B.加压???? C.升温????? D.使用催化剂
(2)某溶液是由体 积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ____c(CH3COOH),混合后溶液中c(CH3COO-)____c(Na+)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如下图所示。

则图中表示醋酸溶液中pH变化曲线的是?????(填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1?????m2(选填<﹑=﹑>)
参考答案:(1)AC(每个1分)???(2)< ;=?????????
本题解析:(1)反应是条件增大、吸热发热可逆反应,所以要增大A的转化率,平衡应该向正反应方向移动,所以选项AC均可以。加压平衡向逆反应方向移动。催化剂不能改变平衡状态。所以正确的答案是AC。
(2)若恰好反应,则生成物醋酸钠水解显碱性,因此要显中性,醋酸一定是过量的。即氢氧化钠的浓度小于醋酸的。
(3)醋酸是弱电解质,存在电离平衡。在反应过程中会继续电离出氢离子,所以醋酸中氢离子的浓度变化程度小于盐酸。因此要使反应后的pH相等,则醋酸需要的时间就多,即B表示醋酸的。醋酸中消耗的氢离子多,则相应的锌消耗的也就多。
本题难度:一般
5、计算题 (7分)在0.1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温下30min后达到平衡。
(1)若得到0.06molSO3,求达平衡时SO2的浓度;
(2)求30min内的反应速率:v(SO3)、v(O2)、v(SO2)。
(3)求平衡时气体压强与开始时气体压强之比。
参考答案:(1)0.4mol/L(2分)(2)0.02mol/(L.m
本题解析:略
本题难度:一般