微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应N2O4(g) 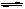 2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是(???)
2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是(???)

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a浅,c深
C.b、c两点的转化率:b>c
D.由b点到a点,可以用加热的方法
参考答案:D
本题解析:
试题分析:根据图像可知,a、c两点都在等温线上,a点压强小于c点压强,所以c点反应速率大于a点反应速率,A不正确;正方应是体积减小的可逆反应,则增大压强平衡向逆反应方向移动,NO2的浓度降低,颜色变浅,B不正确;b、c两点的NO2含量相同,转化率相同,C不正确。由b点到a点,NO2的含量增大,说明平衡向正反应方向移动。易于正方应是吸热反应,所以可以用加热的方法,D正确,答案选D。
点评:该题是中等难度的试题,主要是考查学生对可逆反应图像识别的掌握情况,意在培养学生的逻辑推理能力,提升的学生的学科素养。该题的关键是明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答。
本题难度:一般
2、填空题 如图所示的装置中发生反应2A2(g)+B2(g)2C(g);△H=" -a" kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题:
(1)此反应的平衡常数表达式为______________________;若将温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(2)比较大小:w1_____ w2(填>、=、<),a、b、c由大到小的关系 ______________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将______________________(填增大,减小或不变)。
(4)若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3 mol/L,则 w1,w3的关系______________________。
(5)能说明A中已达到平衡状态的是????????????(填序号,有一个或多个选项符合题意)。
a、v(C)=2v(B2)??????????????????
b、容器内气体压强保持不变
c、容器中气体的平均相对分子质量不随时间而变化?????????????
d、容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体?????????????b、适当升高温度
c、增大B2的浓度????????????????? d、选择高效的催化剂
参考答案:(1).K=?????减小
(2)<????? a >
本题解析:
试题分析:(1)由平衡常数的定义可确定反应的平衡常数的表达式,又因为反应为放热反应,所以升高至7000C,平衡常数减小;(2)因为A容积固定,随反应进行压强减小,而B容积可变,压强始终保持不变,所以B中有利于反应的进行,w1< w2,且可知放出的热量a >c > b,(3)若打开K,一段时间后重新达平衡,容器A、B相通,B的体积将减小;(4)假设B的体积为A的两倍,则平衡时C的浓度w3 ="2" w1,而题中A、B的体积相等,所以B中反应向正反应方向进行,则w3 >2 w1
(5)因为反应前后气体的化学计量数之和不相等,所以压强和平均相对分子质量可以作为平衡状态的标志,(6)要增大反应速率,且使平衡正向移动,可增大B2的浓度。
本题难度:困难
3、选择题 下列事实不能用勒沙特列原理解释的是(???)
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③把pH=2的NaHSO4溶液加水稀释至10倍,c(OH-)却上升了10倍
④常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
⑤在滴有酚酞的Na2CO3溶液中滴CaCl2溶液,生成沉淀的同时溶液颜色由红逐渐变无
⑥对于H2+I2 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加
⑦在双氧水的分解实验中添加MnO2能使分解速率显著加快
A.①③④
B.②⑥⑦
C.③④⑤
D.②③⑤
参考答案:B
本题解析:
试题分析:勒沙特列原理是化学平衡移动原理,能用该原理解释的事实具备条件是涉及可逆反应平衡移动且符合平衡移动原理。①氯化铁溶液存在平衡:FeCl3+3H2O Fe(OH)3+3HCl,盐类的水解吸热,升高温度平衡正向移动,盐酸易挥发,生成氢氧化铁固体,能用勒沙特列原理解释;②铁在潮湿的空气中能形成原电池,加快腐蚀,不能用勒沙特列原理解释;③NaHSO4溶液加水稀释,涉及水的电离平衡移动,能用勒沙特列原理解释;④常温下,醋酸溶液存在电离平衡:CH3COOH
Fe(OH)3+3HCl,盐类的水解吸热,升高温度平衡正向移动,盐酸易挥发,生成氢氧化铁固体,能用勒沙特列原理解释;②铁在潮湿的空气中能形成原电池,加快腐蚀,不能用勒沙特列原理解释;③NaHSO4溶液加水稀释,涉及水的电离平衡移动,能用勒沙特列原理解释;④常温下,醋酸溶液存在电离平衡:CH3COOH CH3COO-+H+加水稀释,平衡正向移动,能用勒沙特列原理解释;⑤Na2CO3溶液存在CO32-的水解平衡:CO32-+H2O
CH3COO-+H+加水稀释,平衡正向移动,能用勒沙特列原理解释;⑤Na2CO3溶液存在CO32-的水解平衡:CO32-+H2O  ?HCO3-+OH-,加CaCl2溶液,钙离子和碳酸根反应生成碳酸钙沉淀,使平衡向左移动,能用勒沙特列原理解释;⑥对于H2+I2
?HCO3-+OH-,加CaCl2溶液,钙离子和碳酸根反应生成碳酸钙沉淀,使平衡向左移动,能用勒沙特列原理解释;⑥对于H2+I2 2HI的平衡体系,加压,平衡不移动,不能用勒沙特列原理解释;⑦在双氧水的分解实验中加MnO2作催化剂能使分解速率显著加快,不能用勒沙特列原理解释;综上所述选B。
2HI的平衡体系,加压,平衡不移动,不能用勒沙特列原理解释;⑦在双氧水的分解实验中加MnO2作催化剂能使分解速率显著加快,不能用勒沙特列原理解释;综上所述选B。
本题难度:一般
4、填空题 (8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
参考答案:(1)向左 不改变
(2)-77.6
(3)Cu
本题解析:本题考查化学平衡的移动、热化学方程式、溶解平衡、溶液中离子浓度大小比较等知识,意在考查考生运用化学基本理论知识的能力。(1)在恒温、恒压条件下向平衡体系中通入氩气,容器体积增大,反应气体的浓度减小,平衡将向气体物质的量增大的方向移动,即向左移动。
(2)根据盖斯定律,ΔH=ΔH1+ΔH2-ΔH3=-77.6 kJ·mol-1。
(3)Ksp[Mg(OH)2]>Ksp[Cu(OH)2],MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀。
(4)因为氨水与盐酸反应后,生成氯化铵溶液,依据电荷守恒得c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),所以溶液呈中性;NH3·H2O的电离常数Kb== mol/L。
本题难度:一般
5、选择题 下列有利于反应自发进行的是(????)
①反应吸热???
②反应放热???
③反应后熵增加???
④反应后熵减小
A.①③
B.②③
C.②④
D.①④
参考答案:A
本题解析:根据△G=△H-T·△S可知,只有△G<0,反应才是自发的,即放热反应和熵值增加的反应是有利于自发的。所以选项A是正确的,答案选A。
本题难度:简单