微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1 mol/L NaCl溶液表示( )
A.1mol NaCl溶于1L水中
B.58.5g NaCl溶于 941.5g水中
C.溶液中含1mol NaCl
D.1L溶液里含NaCl 58.5g
参考答案:D
本题解析:考查物质的量浓度的含义。单位体积溶液里所含溶质的物质的量,称作物质的量浓度。体积是溶液的体积而不是容积的体积,A不正确。B中溶液的体积不一定是1L,B不正确。C中没有指明溶液的体积,无法计算溶质的物质的量。所以正确的答案是D。
本题难度:一般
2、实验题 配制1.50mol·L-1的NaOH溶液100mL:
(1)某学生操作如下:
①用托盘天平称出6.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,再于左盘放粒状氢氧化钠,右盘放上砝码至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线。
③写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误
①__________________________;②_________________________
③__________________________;④_________________________
⑤__________________________;⑥_________________________
⑦__________________________
(2)下列操作造成所配溶液浓度偏高的是_______________
A.所用NaOH已经潮解;
B.用带游码的托盘天平称NaOH时误用了“左码右物”方法
C.未润洗溶解用的烧杯里;
D.未冷却到室温就注入容量瓶
E.定容时,俯视视刻度线;
F.托盘天平的砝码已生锈
参考答案:(1)①NaOH应放在干燥的烧杯中称量;②用过的游码未拨回原
本题解析:
本题难度:一般
3、填空题 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
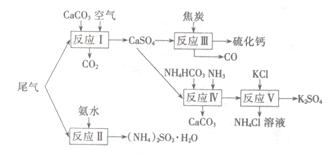
(1)反应III中氧化剂与还原剂的物质的量之比为 。
(2)反应Ⅳ的化学方程式为 。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为 。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下:
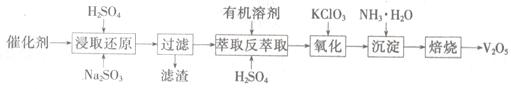
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____ 的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为 。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为 。
参考答案:(1)1
本题解析:
本题难度:困难
4、选择题 设NA为阿伏伽德罗常数的值,下列说法正确的是
A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电了数为0.3NA
B.7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数大于0.1NA
C.50mL l8.4mol·L-1浓浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
D.常温常压下,46gNO2和N2O4的混合物中含有2NA个氧原子
参考答案:D
本题解析:
试题分析:A、5.6g铁粉在0.1mol氯气中充分燃烧生成氯化铁,5.6g铁粉反应需要0.15mol氯气,所以氯气不足,根据氯气计算转移的电子数,所以反应转移电子数为0.1mol×2×NAmol-1=0.2NA,A错误;7.8gNa2S中含有的阴离子数为7.8/78×NAmol-1=NA,过氧化钠有钠离子和过氧根离子构成,7.8g Na2O2中含有的阴离子数为7.8/78×NAmol-1=NA,所以7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数等于0.1NA,B错误;C、随着反应的进行,浓硫酸渐渐变成稀硫酸,就不再和铜发生反应,所以生成SO2分子的数目小于0.46NA,错误;D、NO2和N2O4的中N原子与O原子的个数比都为1:2,46gNO2和N2O4含有的氧原子总数为46/46×2NA=2NA,正确,选D。
考点:考查物质的量的计算。
本题难度:困难
5、填空题 往AgNO3溶液中加入某浓度的盐酸(密度为1.12g/ml),至恰好沉淀完全,此时溶液的质量与原AgNO3溶液的质量相同,则此盐酸溶液的质量分数为_______,物质的量浓度为_______________。
参考答案:25.4%??? 7.8mol/L
本题解析:略
本题难度:简单