微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要仪器有:量筒,烧杯,玻璃棒,胶头滴管,________。
(2)现有下列配制操作:
A用量筒量取浓H2SO4 B反复颠倒摇匀 C用胶头滴管加水至刻度
D洗净并干燥所用仪器 E.稀释浓H2SO4 F.将溶液转入容量瓶
其正确的操作顺序为:___________ 。
(3)简要回答下列问题:
①所需浓硫酸的体积为_______mL。
②如果实验室有15mL 、20mL、 50mL的量筒,应选用 _____mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取将使配制的浓度_____________(偏高、偏低、无影响)。
参考答案:(10分)(1) 500 m L容量瓶,(2)D A E F
本题解析:
试题分析:(1)用液体配制500mL溶液时需用的仪器除量筒,烧杯,玻璃棒,胶头滴管外海油500mL的容量瓶;
(2)配制溶液先是洗涤仪器,然后量取溶液的体积,溶解(或稀释),移液,洗涤后再移液,定容,摇匀,所以正确的操作顺序为:D A E F C B;
(3)①98%的浓硫酸(ρ=1.84g/cm3)的物质的量浓度是1000×1.84×98%/98=18.4mol/L,设所需浓硫酸的体积是xL,则18.4x=0.5mol/L×0.5L,x=0.0136L,所以需要浓硫酸的体积是13.6ml;
②选择量筒时依据量取液体的体积确定,量程越小越准确,所以选择15mL的量筒较好;量取时发现量筒不干净,用水洗净后直接量取,相当于稀释了浓硫酸,将使配制的浓度偏低。
考点:考查溶液的配制操作,误差的分析
本题难度:一般
2、选择题 等质量的H2S和PH3所含的粒子数不同的是( )
A.分子数
B.原子数
C.质子数
D.电子数
参考答案:B
本题解析:略
本题难度:一般
3、选择题
A.28 g氮气所含有的原子数目为N
B.4 g金属钙变成钙离子时失去的电子数目为0.1N
C.1 mol甲烷的质量与N个甲烷分子的质量之和相等
D.标准状况下,22.4 L甲烷和乙炔混合物所含的分子数为N
参考答案:CD
本题解析:此题考查的是物质的量、质量和粒子数目三者之间的关系。28 g N2的物质的量为1 mol,含氮原子2N个;4 g钙为0.1 mol,反应中失去0.2N个电子。
本题难度:简单
4、选择题 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为[???? ]
A.(y-2x)/a mol/L
B.(y-x)/a mol/L
C.(2y-2x)/a mol/L
D.(2y-4x)/a mol/L
参考答案:D
本题解析:
本题难度:一般
5、选择题 在Na2SO4和Al2(SO4)3的混合溶液中,如果[SO42-]=0.3mol?L-1,当加入等体积的0.2 mol/L的NaOH溶液时,生成沉淀恰好完全溶解,则原混合溶液中Na+物质的量浓度是:
A.0.5 mol/L
B.0.3 mol/L
C.0.45 mol/L
D.0.225 mol/L
参考答案:C
本题解析:由题意知反应的方程式为Al2(SO4)3+8NaOH=2NaAlO2+3Na2SO4+4H2O,因此硫酸铝的浓度为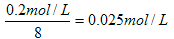 ,即;硫酸铝中c(SO32-)=0.075mol·L-1。所以硫酸钠的浓度是0.3mol/L-0.075mol/L=0.225mol/L,所以钠离子浓度0.225mol/L×2=0.45mol/L。
,即;硫酸铝中c(SO32-)=0.075mol·L-1。所以硫酸钠的浓度是0.3mol/L-0.075mol/L=0.225mol/L,所以钠离子浓度0.225mol/L×2=0.45mol/L。
本题难度:简单