微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 据文献报道,有人提出由焦炭与水和氧气在一定条件下制取重要的有机化工原料醋酸:
2C(s)+2H2(g)+O2(g)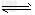 CH3COOH(l) 已知:
CH3COOH(l) 已知:
(1)CH3COOH(l)?+?2O2(g)?=?2CO2(g)+?2H2O(l)???△H1?=?-870.3kJ/mol ?
(2)C(s)?+?O2(g)?=?CO2(g)????△H2?=?-393.5?kJ/mol
(3)H2(g)?+?1/2O2(g)?=?H2O(l)?????△H3?=?-285.8kJ/mol
试回答:
(1)1molH2(g)所具有的能量比1mol?H2O(l)所具有的能量__________(填“高”、“低”或“无法比较”)。
(2)反应2C(s)+2H2(g)+O2(g)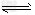 CH3COOH(l)的焓变为________________。
CH3COOH(l)的焓变为________________。
(3)在下列选项中选择用此法制取醋酸的最适宜条件__________(填字母)。
A.常温???B.适当高温????C.合?适催化剂??D.常压????E.适当高压
2、简答题 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O?(l)△H1=-2741.8kJ/mol
????? ②2CO?(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
(1)反应C3H8(g)+5O2(g)═3CO2(g)+4H2O?(l)?的△H=______.
(2)现有1mol?C3H8在不足量的氧气里燃烧,生成1mol?CO和2mol?CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O?(g)?CO2(g)+H2(g)△H=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是______.
a.体系中的压强不发生变化
b.v?正(H2)=v?逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=______.
③向平衡体系中充入少量CO则平衡常数______(填“增大”、“减小”或“不变”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-由______极移向______极(填“正”或“负”);电池的负极电极反应式为______.
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为______.
3、简答题 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g)
催化剂
?CH3CH2OH(g)+3H2O(g)???25℃时,K=2.95×1011
②2CO(g)+4H2(g)催化剂
CH3CH2OH(g)+H2O(g)???25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K=______.
(2)条件相同时,反应①与反应②相比,转化程度更大的是______;以CO2为原料合成乙醇的优点是______(写出一条即可).
(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
网站客服QQ: 960335752 - 14613519 - 791315772