微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法合理的有( )
A.新制的漂白粉是纯净物
B.液氯可以使干燥的红色纸片褪色
C.新制氯水光照有O2产生
D.氢氟酸可保存在密封的细口玻璃瓶中
参考答案:C.
本题解析:
试题分析:A.漂白粉为氯化钙和次氯酸钙的混合物,故A错误;B.氯气不具有漂白性,当与水反应时生成HClO,HClO具有漂白性;C.氯水中含有HClO,在光照条件下分解生成氧气,故C正确;D.氢氟酸能与玻璃中二氧化硅反应,能腐蚀玻璃,故D错误.
本题难度:一般
2、选择题 关于漂粉精的说法正确的是
A.工业上用氯气与澄清的石灰水反应可制得漂粉精
B.漂粉精固体中加入浓盐酸可生成氯气,加入稀盐酸不反应
C.用pH试纸测试可知漂粉精溶液呈碱性
D.漂粉精在空气中会变质,并且有氧化还原反应发生
参考答案:D
本题解析:
试题分析:A.工业上用氯气与浓石灰水反应可制得漂粉精,错误;B.漂粉精固体中加入浓盐酸可生成氯气,加入稀盐酸也能反应生成氯气,错误;C.由于漂粉精溶液水解后生成次氯酸有漂白性,不能用PH试纸测定其碱性,错误;D.漂粉精在空气首先和二氧化碳反应生成次氯酸,然后次氯酸分解生成氯化氢和氧气,后者是氧化还原反应,正确。
本题难度:一般
3、填空题 实验室通常用二氧化锰和浓盐酸反应制取氯气写出反应方程式______________,浓盐酸还可以和氯酸钾发生反应制取氯气写出反应方程式______________,氯气具有较强的__________性。
参考答案:MnO2+4HCl 本题解析:考查氯气制备化学方程式的书写以及氯气的主要性质。氯元素的最外层电子数是7个,极易得到1个电子,达到8电子稳定结构,所以氯气具有强氧化性。
本题解析:考查氯气制备化学方程式的书写以及氯气的主要性质。氯元素的最外层电子数是7个,极易得到1个电子,达到8电子稳定结构,所以氯气具有强氧化性。
本题难度:简单
4、填空题 (8分)
(1)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是????????????????????,该实验说明的问题是????????????????????。
(2)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是???(填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是????????????????????。
参考答案:(1)SO2;SO2与有色物质结合成的无色物质不稳定
本题解析:(1)二氧化硫和有色物质化合生成不稳定无色物质,加热后又可恢复;氯气漂白是靠的强氧化性,将有色物质氧化成无色物质,且过程不可恢复。
(2)SO2+C12+2H2O=4H++SO42-+2Cl-,检查有无硫酸根生成,来证明是否发生氧化还原!用可溶性钡盐来检验硫酸根的存在!
本题难度:一般
5、选择题 下列含氯的化合物中,溶于水后,能直接电离出Cl-的是
A.FeCl3
B.NaClO
C.KClO3
D.KClO4
参考答案:A
本题解析:FeCl3====Fe3++3Cl-,NaClO====Na++ClO-
KClO3====K++ClO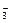 ,KClO4====K++ClO
,KClO4====K++ClO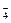 本题难度:简单
本题难度:简单