微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 化学电池是 ___????????????????????的装置,其反应的基础是_???????????????????。写出铜锌原电池(稀硫酸为电解质)的电极反应:正极?????????????????????,负极??????????????????????????。
参考答案:化学能转化为电能,自发进行的氧化还原反应、2H+ +2e—
本题解析:略
本题难度:简单
2、填空题 原电池中发生的化学反应属于??????????___,原电池将???? _____转化为?????____?能。其中,电子流出的一极是原电池的????_?__? 极,该极发生??????____ 反应,电子流入的一极是原电池的?????? 极,该极发生??????__ 反应。原电池中电解质溶液的作用是???????___?。
参考答案:氧化还原反应,化学,电,负,氧化,正,还原,导电。
本题解析:
本题难度:一般
3、选择题 当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是????????????????????????????????????????
A.电池的正极反应式为:O2十2H2O十4e-=4OH-
B.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
C.电解后c(Na2CO3)变小
D.电池中c(KOH)不变;电解池中溶液pH变大
参考答案:A
本题解析:
试题分析:燃料电池正极发生还原反应,A正确;负极为氢气放电,当消耗mg气体时,则转移了m mol电子,电解池阳极为氢氧根离子在放电,此时生成m/4 mol氧气,则8mg,B错;电解饱和碳酸钠溶液,实则电解水,碳酸钠的浓度不变,C错;电池中KOH的浓度变小,D错。
点评:电解池是历年高考常考知识点,注重考查学生分析问题、解决问题的能力。近年来常以新型电解池进行考查。
本题难度:一般
4、选择题 有关右图装置中的叙述正确的是
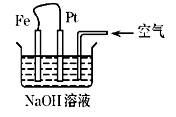
A.这是电解NaOH溶液的装置
B.这是一个原电池装置
C.Pt为负极,其电极反应为:O2+2H2O+4e-= 4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH- = 2Fe(OH)2
参考答案:B
本题解析:
试题分析:A、由题给装置图知,该装置无外加直流电源,不是电解NaOH溶液的装置,错误;B、这是一个原电池装置,正确;C、原电池中较活泼的金属作负极,故Pt为正极,其电极反应为:
O2+2H2O+4e-= 4OH-,错误;D、原电池中较活泼的金属作负极,Fe为负极,其电极反应为:
Fe-2e-+2OH- = 2Fe(OH)2,错误。
本题难度:一般
5、选择题 以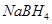 (B元素的化合价为+3)和
(B元素的化合价为+3)和 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是

A.该电池工作时Na+由a极区移向b极区
B.电极b是原电池的正极
C.该电池的负极反应为:
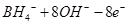 =
=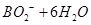
D.电路中通过6.02×1022个电子时,理论上消耗 mol
mol
参考答案:D
本题解析:
试题分析:B、H2O2具有强氧化性,易得电子,所以电极b为原电池的正极,正确;A、电池内部阳离子向正极移动,所以该电池工作时Na+由a极区移向b极区,正确;C、BH4-在负极上失去电子,生成BO2-,配平可得电极方程式:BH4-+8OH?—8e?= BO2-+6H2O,正确;D、根据化合价的变化可得H2O2与转移电子的对应关系:H2O2 ~2e?,所以电路中通过6.02×1022个电子时,理论上消耗H2O2 0.05mol。
本题难度:简单