微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图所示A管中装有Fe粉和适量的稀H2SO4,B管中装有足量的NaOH溶液。某同学用该装置制Fe(OH)2。完成下列填空:

(1)打开a,使A管中反应进行一段时间。
(2)夹紧止水夹a,在B管中可观察到的现象是:????????????????, B中发生反应的离子方程式为???????????????????。
(3)该同学进行(1)操作的目的?????????????。
参考答案:(2)A管中液体进入B管中,B管中产生白色沉淀? Fe2++
本题解析:
试题分析:该实验制备氢氧化亚铁的原理为:A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气,可排除试管中的氧气,可防止生成的Fe(OH)2被氧化,当反应一段时间后通过关闭a,可将A中的液体压入到B中,从而制得目标物。
本题难度:一般
2、填空题 某化学课外活动小组在实验室做了如下一系列实验:
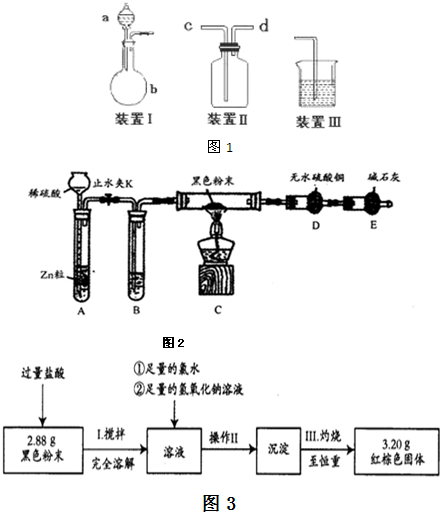
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______?(填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
参考答案:一、①装置Ⅰ可作为实验室制氧气的快速发生器,是分液漏斗中a的
本题解析:
本题难度:一般
3、选择题 下列有关物质应用的说法不正确的是( )
A.氧化铁可用来制造红色油漆和涂料
B.二氧化硫可用来加工食品,使食品增白
C.硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂
D.浸泡过高锰酸钾溶液的硅土可用来延长果实或花朵的成熟期
参考答案:B
本题解析:
本题难度:简单
4、实验题 某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
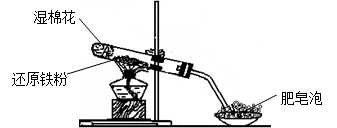
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为____________________________________。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许固体物质于试管中,并向试管中加稀硫酸得溶液B;
②取少量溶液B于试管中,滴加几滴KSCN溶液,结果溶液未变红色,说明硬质试管中固体物质的成分有:____________________________。(填化学式)
(3)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图
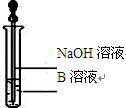
所示的操作,可观察到先生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
①?????????????????????????????????????????????????????????????????????;
②?????????????????????????????????????????????????????????????????????。
(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有?????????性。由此可知,实验室中FeSO4溶液要临时配制并加少量铁粉的原因是??????????。(用离子方程式表示)
参考答案:(1)3Fe+4H2O(g) 本题解析:
本题解析:
试题分析:(1)本题为铁与水蒸汽的反应实验,硬质试管中发生反应的化学方程式为:
3Fe+4H2O(g)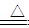 Fe3O4+4H2,(2)滴加几滴KSCN溶液,结果溶液未变红色,说明该溶液中并没有铁离子,说明铁离子被铁还原为亚铁离子,所以固体物质的成分为Fe3O4和Fe;(3)B溶液中含有亚铁离子,所以加入
Fe3O4+4H2,(2)滴加几滴KSCN溶液,结果溶液未变红色,说明该溶液中并没有铁离子,说明铁离子被铁还原为亚铁离子,所以固体物质的成分为Fe3O4和Fe;(3)B溶液中含有亚铁离子,所以加入
本题难度:一般
5、选择题 将Cu片放入0.l mol / L FeCl3溶液中,一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
A.3 : 2
B.3 : 5
C.4 : 3
D.3 : 4
参考答案:D
本题解析:设参加反应的铜的物质的量是x,则根据方程式Cu+2Fe3+=Cu2++2Fe2+可知,消耗铁离子是2x,生成亚铁离子是2x,则溶液中铁离子的物质的量是2/3×2x=4x/3,所以溶液中铜离子和铁离子的物质的量之比是3 : 4,答案选D。
本题难度:简单