微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________, K值大小与温度的关系是:温度升高,K值______________ (填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)
 CO2(g)十H2(g)十Q(Q>0) CO和H2O浓度变化如下图,则0-4min的平均反应速率v(CO)=______
CO2(g)十H2(g)十Q(Q>0) CO和H2O浓度变化如下图,则0-4min的平均反应速率v(CO)=______
mol/(L·min)
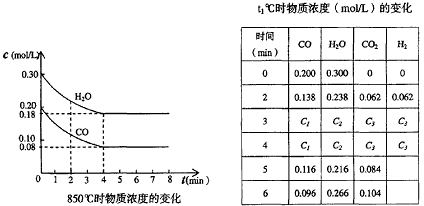
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
2、填空题 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2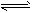 CHCl3+HCl 此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+HCl 此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
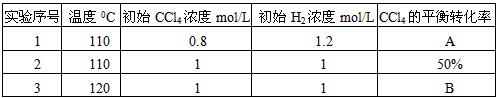
(1)110℃时平衡常数:______________
(2)实验1中,CCl4的转化率A为:______________
(3)实验2中,10小时后达到平衡,H2的平均反应速率为:______________。在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向______________反应方向移动(填“正”、“逆”或“不移动”);
(4)实验3中,B的值______________
①等于50% ②大于50% ③小于50% ④无法判断
3、选择题 下列事实中不能用勒夏特列原理来解释的是( )
A.向H2S水溶液中加入NaOH固体有利于S2-增多
B.鼓入过量空气有利于SO2转化为SO3
C.高压对合成氨有利
D.500℃左右比室温更有利于氨的合成
4、选择题 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:
CO+HbO2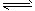 O2+HbCO ,37 ℃时,该反应的平衡常数K=220。 HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是[???? ]
O2+HbCO ,37 ℃时,该反应的平衡常数K=220。 HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是[???? ]
A.CO与HbO2反应的平衡常数K=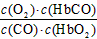
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
5、选择题 已知:H2(g)+I2(g?2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI?0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度
B.甲中加入0.1?mol?He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1?mol?H2,乙增加0.1?mol?I2