微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子在所给条件下能够大量共存的是
A.pH =0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B.水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2-
C.使紫色石蕊试液显蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42-
D.溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH-
参考答案:A
本题解析:离子间如果发生化学反应,则不能大量共存,反之可以大量共存。B中水的电离是被抑制的,因此溶液可能显酸性,也可能显碱性。HCO3-和H+或OH-都反应,所以不能大量共存。C中溶液是显碱性的,镁离子和铁离子不能大量共存。D中hCO3-和OH-都反应CO32-,不能大量共存,答案选A。
本题难度:一般
2、选择题 100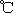 时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是
时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是
参考答案:C
本题解析:混合呈中性,故有氢离子浓度等于氢氧根离子浓度。100×10-a=1×10-(12-b)(100℃,PKw=12);故有a+b=14
本题难度:简单
3、填空题 (12分)下列物质 ①Cu ②液态SO2? ③纯醋酸? ④NaHCO3 ⑤Ba(OH)2溶液
I、属于非电解质的是?????(填序号)Ⅱ、⑴NaHCO3是一种???(填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式:?????????????????????????????;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为:??????????????????????????????????????????。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=?????????????。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=?????????????。(已知:10-5.60=2.5×10-6)
Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴溶液中由水电离出c(OH―)=______________;
⑵与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
参考答案:(12分) I、②(1分)
Ⅱ、⑴强(1分) ⑵HCO
本题解析:
试题分析: I、溶于水和在熔融状态下均不能导电的化合物是非电解质,所以属于非电解质的是SO2,答案选②。
Ⅱ、(1)溶于水完全电离的电解质,不存在电离平衡的是强电解质,因此碳酸氢钠是强电解质。
(2)碳酸氢钠水解的离子方程式是HCO3― + H2O H2CO3 + OH―。
H2CO3 + OH―。
(3)常温下
本题难度:一般
4、选择题 下列各组离子一定能大量共存的是 [???? ]
A.加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-
B.含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C.c(H+)/c(OH-)=l×10-10的溶液中:NH4+、K+、Ca2+、Cl-
D.水电离的c(H+)=l×10-12mol/L的溶液中:Na+、K+、HCO3-、Cl-
参考答案:A
本题解析:
本题难度:一般
5、选择题 常温下,下列各组离子在指定溶液中能大量共存的是( )
A.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO-
B.滴入酚酞显红色的溶液中:NH4+、Mg2+、AlO2-、NO3-
C.pH=1的溶液中:Fe3+、Cl-、NO3-、K+
D.c(SO32-)=0.1mol?L-1的溶液中:Ca2+、MnO4-、SO42-、H+
参考答案:A、加入铝粉产生H2的溶液可能为酸或碱的溶液,若为碱,OH-
本题解析:
本题难度:一般