微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物.各种生成物在平衡体系内的分压与反应温度的关系如图所示(己知气体的分压之比等于物质的量之比).
(1)420K时,发生反应的化学方程式为:______;若反应中消耗1?mol?Xe,则转移电子______mol.
(2)600~800K时,会发生反应:XeF6(g)?XeF4(g)+F2(g),
其反应热△H______0(填“>”“=”或“<”).理由是______.
(3)900K时,容器中存在的组分有______.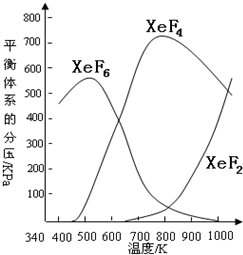
2、选择题 关于化学平衡常数的叙述正确的是( )
A.温度一定,一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为相反数
D.浓度商Qc<Kc,?v(正)<v(逆)
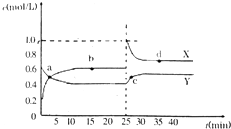
3、填空题 已知:2NO2(g)?N2O4(g)△H<O.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
(1)a、b、c、d四个点中,化学反应处于平衡状态的是______点.
(2)25min时,增加了______(填物质的化学式)______mol,平衡向生成______(填“NO2、N2O4”)反应方向移动.
(3)a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是______(填字母).
4、选择题
|
5、填空题 单质碘与红磷在常温下混合不反应,但滴入几滴水后能剧烈反应,生成HI和H3PO3。但实验室制取氢碘酸的方法是把H2S通入I2水中,过滤生成的硫,可得质量分数为50%的氢碘酸
(1)写出实验室制取氢碘酸的化学方程式______________________;
(2)氢碘酸在空气中放置易易氧化变质,写出可能发生反应的化学方程式___________________________;
(3)为防止氢碘酸在空气中氧化变质,可在氢碘酸中加入少量___________,写出有关反应的化学方程式__________________________。??????
(4)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
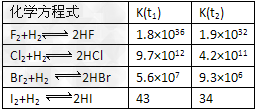
①已知t2>t1,HX的生成反应是__________?反应(填“吸热”或“放热”)。
②共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是_______________。
③仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_________________(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱????
d.HX的稳定性逐渐减弱