微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 CO(g)+H2O(g)?CO2(g)+H2(g)在1000K达到平衡时,分别改变下列条件,K值发生变化的是( )
A.将反应温度升高至1200?K
B.将压强减小至原来的一半
C.添加催化剂
D.增大水蒸气的浓度
2、填空题 (1)高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g)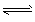 Fe(s)+CO2(g) △H>O,其平衡常数可表示为
Fe(s)+CO2(g) △H>O,其平衡常数可表示为
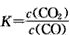 ,已知1373K时K=0. 263。
,已知1373K时K=0. 263。
①温度升高,化学平衡移动后,平衡常数K值___(填“增大”、“减小”或“不变”)。
②1373K时测得高炉中c(CO2)=0. 025mol/L,c(CO) =0.1mol/L,在这种情况下,该反应是否处于化学平衡状态____(填“是”或“否”)。此时,化学反应速率v(正)___v(逆)(填“大于”、“等于”或“小于”),其原因是___。
(2)抽烟对人体有害,烟草不完全燃烧产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应CO(g)+Hb·O2 (g)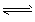 O2 (g)+Hb·CO(g),实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,足以使人的智力受损,试回答: ①上述反应的平衡常数表达式为K=___。 ②已知37℃时,该反应平衡常数K=220,抽烟后,测得吸入肺部的空气中的CO和O2的浓度分别为1×10-6 mol/L和1×10-2mol/L,能否使人的智力受损____(填“能”或“否”),理由是___。
O2 (g)+Hb·CO(g),实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,足以使人的智力受损,试回答: ①上述反应的平衡常数表达式为K=___。 ②已知37℃时,该反应平衡常数K=220,抽烟后,测得吸入肺部的空气中的CO和O2的浓度分别为1×10-6 mol/L和1×10-2mol/L,能否使人的智力受损____(填“能”或“否”),理由是___。
3、选择题 下列各表述与示意图一致的是
 [???? ]
[???? ]
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20mL 0.1mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)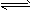 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10mL 0.01mol·L-1KMnO4酸性溶液与过量的0.1mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g) CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化
4、填空题 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200
K
1.7
1.2
1.0
0.6
0.4
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______;
(2)该反应为______反应(填“吸热”或“放热”);
(3)能判断该反应是否达到化学平衡状态的依据是______.
A、容器中压强不变B、c(CO2)=c(CO)
C、ν(CO)=ν(H2O)D、混合气体中c(CO2)不变
(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O).试判断此时的温度为______℃
5、选择题 下列各表述与示意图一致的是
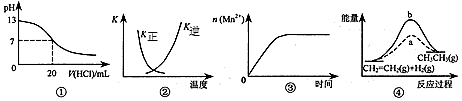 [???? ] [???? ]
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 B.图②中曲线表示反应2SO2(g) + O2(g)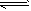 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
|