微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少 量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
I.称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4?2H2O?)溶液标定其浓度。已知: MnO4-(H+)→Mn2+、?? H2C2O4→ CO2反应中其他元素没有得、失电子。请回答下列问题:
(1)写出在硫酸酸化的条件下KMnO4与H2C2O4反应的离子方程式是???????????????;
(2)如何保证在700C-800C条件下进行滴定操作: ????????????;
(3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是?????????????;
(4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾 溶液V mL。问:
溶液V mL。问:
①滴定终点标志是????????????????????????????????????????;
②KMnO4溶液的物质的量浓度为??????????????????????mol·L-1;
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将????????????????? -------(填“偏高”或“偏低”)
参考答案:(1)6H++2MnO4-+5H2C2O4=2Mn2++10
本题解析:略
本题难度:简单
2、实验题 Ⅰ.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质
| Al
| Al2O3
| Fe
| Fe2O3
|
熔点/℃
| 660
| 2054
| 1535
| 1462
|
沸点/℃
| 2467
| 2980
| 2750
| ——
铝热反应方程式为???????????????????????????????????????.
下列能与Al发生铝热反应的有???????。(填序号)
A、MnO2???????? B、Na2O????C、MgO?????? D、FeO
据上表数据该同学推测,铝热反应所得到的熔融物应是铁铝合金。若证明上述所得的块状熔融物中含有金属铝,所用试剂是??????????,该试剂溶质的电子式为?????????。
Ⅱ.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的实验仪器有
_______________等。(填代号,下同)
A、试管;B、坩埚;C、烧杯;D、三角架;E、泥三角;F、洒精灯;G、铁架台;H、量筒
第2步:Iˉ溶液的获取。操作是将灰烬转移到烧杯中,加适量蒸馏水,用玻棒充分搅拌,煮沸,冷却,________。(填分离方法)
(3)第3步:氧化。取(2)中溶液少量依次加入合适的试剂。下列氧化剂最好选_________。
A、浓硫酸???? B、新制氯水????? C、KMnO4溶液??????D、H2O2
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加_______溶液,证明海带中含碘。
参考答案:Ⅰ(1)2Al+Fe2O3 本题解析: 本题解析:
试题分析:Ⅰ(1)在高温下,金属铝能和氧化铁发生置换反应,责任铝热反应方程式为2Al+Fe2O3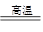 2Fe+Al2O3。 2Fe+Al2O3。
(2)钠和镁是活泼的金属,则氧化钠和氧化镁不能与铝发生铝热反应,二氧化锰和氧化亚铁可以,答案选AD。
(3)铝和铁都能溶于盐酸中,但金属铝还能和氢氧化钠溶液反应,所以若证明上述所得的块状熔融物中含有金属铝,所用试剂是氢氧化钠溶液。氢氧化钠是离子化合物,其电子式是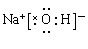 。 。
Ⅱ(1)固体灼烧在坩埚中进行,其中坩埚需要放在泥三角但三脚架上,所以需要的仪器有坩埚、泥三角、三脚架和 酒精灯,即答案选BDEF。
(2)分离难溶性的固体和可溶性的含有碘元素的液体的操作是过滤。
(3)具有氧化性的物质可以将碘离子氧化为单质碘,双氧是绿色氧化剂,在酸性环境下,氧化碘离子的实质是:H2O2+2H++2I-=2H2O+I2,还原产物是水,不会产生杂质,所以答案选D。
(4)碘遇淀粉显蓝色,则滴加淀粉溶液,证明海带中含碘。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生实验能力的培养和训练。化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容在高考命题中一方面是单独命题,另一方面是出现在综合实验试题中,就前者来说,今后仍然是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、选择题 浓硫酸包装上所帖的危险化学品标志是
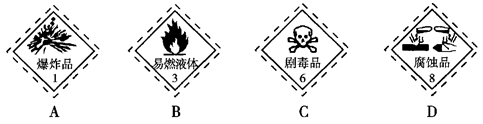
参考答案:D
本题解析:浓硫酸不是易燃、易爆、有剧毒的物质,但它具有很强的氧化性,腐蚀性特别强,应贴有腐蚀品标志,选D
本题难度:简单
4、选择题 下列是一些实验操作的示意图,其中不正确的是?

A???????????????B?????????????C?????????????????D
参考答案:B
本题解析:
试题分析:A、给液体加热时,试管内液体不能超过其体积的1/3,防止沸腾溅出;试管与桌面成约45°角,故A正确;
B、用胶头滴管滴加液体时,滴管不可伸入试管内,否则会污染药品,故B错误;
C、取用粉末状或小颗粒状的药品时先将试管横放,把盛药品的药匙或纸槽小心地送入试管底部,再使试管直立,故C正确;
D、取用液体时试剂瓶瓶口要紧挨试管口,防止液体流出;标签向着手心,防止液体流出腐蚀标签;瓶塞倒放桌面上,防止污染瓶塞,从而污染药品.故D正确。
故选B。
点评:本题主要了解各操作的注意事项;掌握常用仪器胶头滴管、掌握加热液体的方法,取用粉末状或小颗粒状的药品和液体的注意事项。
本题难度:简单
5、选择题 下列实验方法正确的是(????? )
A.实验剩余的所有药品均不能放回原瓶
B.酒精灯着火可以用水灭火
C.过滤时滤纸和漏斗之间残留气泡
D.点燃可燃性气体时先验纯
参考答案:D
本题解析:
试题分析:实验剩余的Na、K、白磷等必须放回原瓶,A错误;酒精灯着火用湿布或沙子扑灭,B错误;过滤时滤纸紧贴漏斗内壁,中间不能留有气泡,C错误;D正确。
点评:实验剩余的Na、K、白磷等必须放回原瓶。
本题难度:简单
|