微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯水在空气中长期放置,不考虑水蒸发的情况下,下列微粒的物质的量会增多的是( )
A.ClO-
B.HClO
C.水
D.Cl-
参考答案:A、氯水在空气中长期放置,次氯酸会分解,次氯酸根离子的量减少
本题解析:
本题难度:简单
2、填空题 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2―→Cl+Cl ②Cl+H2―→HCl+H ③H+Cl2―→HCl+Cl ……
反应②中形成的化合物的电子式为______;反应③中被破坏的化学键属于______键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________???????(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第________周期________族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是____。
a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b.卤化氢的键长按H—F、H—Cl、H—Br、H—I的顺序依次减小
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(4)卤素单质的键能大小如图。由图推断:

①非金属性强的卤素,其单质分子的化学键________断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:______________________________________。
参考答案:
(1)H∶····∶ 非极性
(2)S>
本题解析:(1)反应②中形成的化合物为HCL,其电子式为:H∶····∶;反应③中被破坏的化学键属于非极性键;
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是:S>Cl>F;与氯元素同周期且金属性最强的元素为金属钠,位于周期表的第三周期,第IA族;
(3)a
(4)①非金属性强的卤素,其单质分子的化学键不一定容易断裂;
②卤素单质键能大小与键长的关系为:除F2外,键长增大,键能减小
本题难度:简单
3、实验题 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
如果要在实验室制取SO2,选用上述两种方法中的????????(填“途径I”或“途径II”)更合理,你的理由是????????????????????????(答出一点就可)。
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。装置B、C、D的作用分别是:
B:???????????????????????????;
C:???????????????????????????;
D:???????????????????????????。
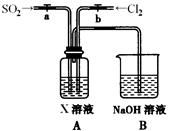
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。

通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若关闭b,打开a,若X为品红溶液,则A中的现象为:?????????,说明二氧化硫具有???????????性。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为:??????????????????,原因是?????????????。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为????????????????,与②现象不同的原因是??????????????????????(书写相应的化学方程式)。
参考答案:(1)途径I(1分)??制备等量的二氧化硫消耗的硫酸少(合理
本题解析:
试题分析:(1)途径I的反应为Na2SO3+H2 SO4 =SO2+Na2SO4+ H2O ,途径II反应为Cu+2H2SO4(浓) =△= CuSO4+SO2↑+ 2H2O,由两反应可知生成等量的SO2 途径I需要的浓硫酸少。
由图可知B装置为收集装置,氯气的密度比空气的密度大,故作用为向上排空气收集氯气。C装置为防止D装置中的溶液进入C中,D中氢氧化钠溶液吸收氯气。(3)①SO2具有漂白性,能使品红褪色
②氯气与水反应生成的盐酸使紫色变为红色,同时生成的 HClO 具有漂白性,使溶
本题难度:一般
4、填空题 某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
??△??
.
?
2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验.
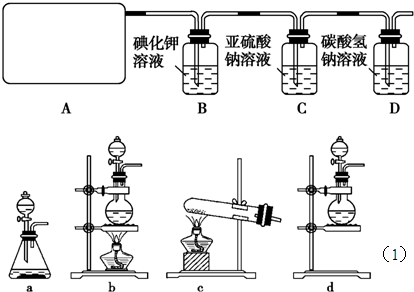
试回答:
(1)该实验中A部分的装置是?(填写装置的序号);
(2)B中反应的化学方程式是?;
(3)写出C中反应的离子方程式?,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):?;
(4)写出在D装置中发生反应的离子方程式?;
(5)该实验存在明显的缺陷是?;
(6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol?L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2═Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3?200mL.则该漂白粉中Ca(ClO)2的质量分数为?.
参考答案:
本题解析:
本题难度:一般
5、选择题 下列气体中有毒、有刺激性气味且有颜色的气体是(???)
A.H2S
B.NH3
C.NO2
D.SO2
参考答案:C
本题解析:略
本题难度:简单
|