微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是
A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2="2" Fe3++Br2+4Cl-
B.用石墨电极材料电解NaCl饱和溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.向CaCl2溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3+2H+
D.醋酸与锌粒反应:2H++Zn2+=H2↑+Zn
参考答案:B
本题解析:A:氯气足量,故溴离子全部被氧化:2Fe2++4Br-+3Cl2="2" Fe3++2Br2+6Cl-
B:正确
C:弱酸不能制取强酸,两者不发生化学反应
D:醋酸为弱电解质,不能拆为离子,不正确
答案为B
本题难度:一般
2、选择题 下列离子方程式正确的是
A.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+===CO2↑+H2O
B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C.碘化亚铁溶液中通入少量Cl2:Cl2+2I-===2Cl-+I2
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4? + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
参考答案:C
本题解析:
试题分析:蛋壳的主要成分是碳酸钙,而碳酸钙难溶于水,应该用化学式表示,A不正确;碳酸氢钠和氢氧化钠反应碳酸钠和水,B不正确;碘离子的还原性强于亚铁离子,氯气不足时,只氧化碘离子,C正确;高锰酸钾溶液能氧化浓盐酸,D不正确,应该用稀硫酸酸化,答案选C。
点评:判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:一般
3、选择题 解释下列事实的反应方程式正确的是
A.氨气遇氯化氢时产生白烟:NH3+HCl=NH4Cl
B.铜与浓硫酸共热产生气体:Cu+H2SO4(浓) CuSO4+H2↑
CuSO4+H2↑
C.铁钉在潮湿的空气中很快被腐蚀:Fe—3e-=Fe3+
D.纯碱溶液能清洗油污:CO32-+2H2O  H2CO3+2OH-
H2CO3+2OH-
参考答案:A
本题解析:
试题分析:A、NH3与HCl反应生成NH4Cl,化学方程式为:NH3+HCl=NH4Cl,正确;B、铜与浓硫酸共热化学方程式为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,错误;C、铁钉在潮湿的空气中腐蚀方程式为:Fe—2e-=Fe2+,错误;D、纯碱分步水解的方程式为:CO32?+H2O
CuSO4+SO2↑+2H2O,错误;C、铁钉在潮湿的空气中腐蚀方程式为:Fe—2e-=Fe2+,错误;D、纯碱分步水解的方程式为:CO32?+H2O
本题难度:一般
4、选择题 下列离子方程式书写不正确的是( )。
A.NaOH溶液与SO2反应,当n(NaOH)∶n(SO2)=4∶3时,4OH-+3SO2=SO32-+2HSO3-+H2O
B.CuCl2溶液与Na2S溶液2∶1反应:Cu2++S2-=CuS↓
C.Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2)=1∶1时:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的盐酸等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O
参考答案:C
本题解析:在氧化还原反应中,还原性(氧化性)强的物质(或微粒)优先参与氧化还原反应。由于还原性Fe2+比Br-强,往FeBr2中通入氯气时,发生的反应依次为①Cl2+2Fe2+=2Cl-+2Fe3+,②Cl2+2Br-=2Cl-+Br2。当n(Cl2)∶n(FeBr2)=1∶1时,发生的离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,C项错误。
本题难度:一般
5、填空题 某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。
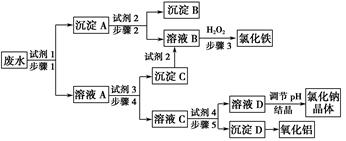
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为__________________________________。
(4)步骤3反应的离子方程式为__________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____________________________。
参考答案:(1)废铁屑 稀盐酸
(2)漏斗、玻璃棒、烧杯
本题解析:所加试剂的关键是有效地将Na+、Al3+、Fe3+、Cu2+、Cl-分离并得到相应产品。若试剂1为足量的废铁屑,Fe与Cu2+、Fe3+、H+反应经过滤后得到含有Fe、Cu的沉淀A,向Fe、Cu混合物中加入足量的稀盐酸得到Cu和FeCl2,FeCl2再与H2O2反应得到FeCl3:2Fe2++H2O2+2H+=2Fe3++2H2O。溶液A中含有Na+、Al3+、Fe2+、Cl-,利用Al(OH)3的两性实现Fe2+、Al3+的分离,所以试剂3为过量的NaOH溶液,沉淀C为Fe(OH)2,其与盐酸反应生成F
本题难度:一般