微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某研究组设想以如图所示装置用电化学原理生产硫酸.关于该装置的叙述正确的是( )
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O-2e-=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上每消耗11.2LSO2,则可产生0.5molH2SO4
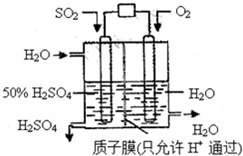
参考答案:A.通入氧气的电极上,氧气得电子发生还原反应,所以通入氧气的
本题解析:
本题难度:简单
2、选择题 右图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
A.c电极上有气体产生
B.d为阳极、c为阴极
C.电解过程中,d电极质量不变
D.电解过程中,氯离子浓度不变
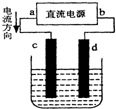
参考答案:在电解池中,电流的流向和电子的移动方向相反,电流是流向阳极,
本题解析:
本题难度:一般
3、选择题
|
如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是
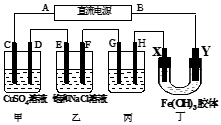 [???? ]
[???? ]
A.电源B是负极
B.甲乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1︰2︰2︰2
C.欲用丙装置给铜镀银,H应该是Ag,电镀液选择AgNO3溶液
D.装置丁中X极附近红褐色变浅,说明氢氧化铁胶粒吸附正电荷
参考答案:C
本题解析:
本题难度:一般
4、填空题 (16分)
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H=+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图。假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
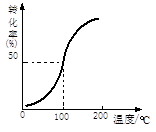
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应II生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
a.c ( H2 )减少;
b.平衡常数K增大;
c.CH3OH 的物质的量增加;
d.正反应速率加快,逆反应速率减慢;
e.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,
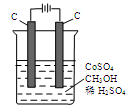
则:
Co2+在阳极的电极反应式为: ;
除去甲醇的离子方程式为 。
参考答案:(1)+77.0 kJ·mol-1 &
本题解析:
试题分析:(1)由盖斯定律,方程式I 和II的焓变相加,可计算得到CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=H2(g) +CH3OH (g) △H =+77.0 kJ·mol-1;由方程式I,结合图像,计算得甲烷表示的化学反应速率为0.01mol·L-1·min-1,进而解得氢气表示的反应速率;(3)改变条件会导致各成分的浓度增大,且压强增大,反应速率增大,平衡正向移动,甲醇的物质的量增加,重新平衡时c ( H2 )/ c (CH3OH )减小。由于温度恒定,所以K值不变;(4)由电解原理,阳极发生氧化反应:Co2+-e-= Co3+(或6Co2+-6e-=6Co3+),由“Co3+将甲醇氧化成CO2和H+”确定除去甲醇的离子方程式:6Co3++CH3OH+H2O ==6Co2++CO2↑+6H+。
考点:盖斯定律、化学反应速率的计算、化学平衡的移动、电极反应式的书写。
本题难度:困难
5、选择题 用铂(惰性)电极进行电解,下列说法中正确的是( )
A.电解稀硫酸,在阴极和阳极分别产生氢气和氧气
B.电解氯化钠溶液,在阴极析出钠
C.电解硫酸钠溶液,在阴极和阳极析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极和阳极析出产物的物质的量之比为1:1
参考答案:A.惰性电极电解稀硫酸,实质为电解水,氢离子在阴极放电生成氢
本题解析:
本题难度:简单