微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 阿伏加德罗常数值是NA,标准状况下,若某氧气和氮气的混合气体n g含有b个分子,则m g该混合气体在标准状况下的体积是(???????? )
A.22.4nb/mNA
B.22.4mb/nNA
C.22.4nNA/mb
D.nbNA/22.4m
参考答案:B
本题解析:n g氧气和氮气的混合气体的物质的量为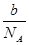 ,则可得m g该混合气体的物质的量为mb/nNA,即标准状况下的体积为22.4mb/nNA
,则可得m g该混合气体的物质的量为mb/nNA,即标准状况下的体积为22.4mb/nNA
本题难度:一般
2、选择题 在标准状况下,将wgA气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为mol/L.
A.
B.
C.
D.
参考答案:A
本题解析:分析:根据n= 来计算气体的物质的量,溶剂和溶质的质量和为溶液的质量,利用V=
来计算气体的物质的量,溶剂和溶质的质量和为溶液的质量,利用V=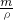 来计算溶液的体积,最后利用c=
来计算溶液的体积,最后利用c= 来计算该溶液的物质的量浓度.
来计算该溶液的物质的量浓度.
解答:气体的物质的量=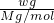 =
= mol,1L水的质量为1000g,溶液的质量为(W+1000)g,溶液的体积为
mol,1L水的质量为1000g,溶液的质量为(W+1000)g,溶液的体积为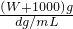 =
=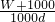 L,所以溶液的物质的量浓度=
L,所以溶液的物质的量浓度=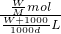 =
=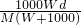 mol/L.
mol/L.
故选A.
点评:本题考查了物质的量浓度的有关计算,明确各物理量之间的关系是解本题的关键.
本题难度:一般
3、计算题 铁盐在工业、农业、医药等领域有重要的价值。
(1)将55.600g绿矾(FeSO4?7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为 ???????g;SO2为????????mol。
(2)实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
Ⅰ.将4.400g铁屑(含Fe2O3)与25mL3mol/L H2SO4充分反应后,得到 FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。
①铁屑中Fe2O3的质量分数是 ????????(保留两位小数)。
Ⅱ.向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。
②t℃时,(NH4)2SO4·FeSO4·6H2O的溶解度是??????????g/100g水(保留两位小数)。
(3)黄铁矾是难溶于水且不含结晶水的盐,它由两种阳离子和两种阴离子构成。工业上常用生成黄铁矾的方法除去溶液中的Fe2+,原理是:用氧化剂将Fe2+氧化为Fe3+,Fe3+的水解产物与溶液中某些离子一起生成黄铁矾沉淀。
实验室模拟工业过程的操作如下:
向1L 0.0500mol/L的稀硫酸中加入16.680g绿矾,完全溶解后,依次加入1.065gNaClO3(式量106.5)和1.610gNa2SO4?10H2O(式量322),充分反应后,得到9.700g黄铁矾沉淀。所得无色溶液中含有的H+为0.16 mol,SO42—为0.075 mol,Cl—为0.01mol。
计算并确定黄铁矾的化学式。
参考答案:
(1)16(3分);0.1(3分)
(2)①
本题解析:
试题分析:
(1)绿矾(FeSO4?7H2O,式量为278)在高温下加热分解的方程式为2FeSO4?7H2O==Fe2O3+SO2+SO3+7H2O,设生成氧化铁的质量是x,二氧化硫的物质的量为y,

Ⅰ、根据题意知,溶液中还有酸剩余,剩余的n(H2SO4)=0.1mol/L×0.5×
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,下列说法正确的是?(?? )??????????????????????
A.1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA
B.Na与足量O2反应生成1 mol Na2O或1 mol Na2O2均失去2NA个电子
C.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA
参考答案:B
本题解析:
试题分析:Al在冷的浓硝酸中钝化,A项错误;铁与盐酸反应后生成Fe2+,铁与氯气反应后生成Fe3+,所以转移的电子数不相等,C项错误;2.7 g铝与足量的NaOH溶液反应,转移的电子总数为3NA,D项错误。答案选B。
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:一般
5、选择题 下列说法正确的是
A.1molO2的质量是32g.mol—1
B.H2的摩尔质量是2g
C.1molH+的质量是1g
D.对原子而言,摩尔质量就是相对原子质量
参考答案:C
本题解析:
试题分析:A选项中单位错误,质量的单位应该是g。B选项中摩尔质量的单位应该是g.mol—1 D选项中,只能说摩尔质量和相对原子质量在数值上相等,它们单位不同,含义也不同。故选C
考点:考查摩尔质量的概念
本题难度:简单