微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,反应A2(气)+B2(气) 2AB(气)达到平衡状态的标志是(?)
2AB(气)达到平衡状态的标志是(?)
A.单位时间里生成 n mol A2,同时生成 n mol AB
B.容器中的总压强不随时间而变化
C.A2、B2、AB的物质的量之比满足1:1: 2
D.单位时间里生成2n mol AB的同时生成n mol B2
参考答案:D
本题解析:
试题分析:A、正、逆反应速率不等,故A错误;
B、该反应前后气体体积不变,所以压强始终不变,故B错误;
C、反应达到平衡时的浓度与反应的初始物质的量以及反应的转化程度有关,所以不能确定是否达到平衡,故C错误;
D、位时间内生成2nmolAB的同时,生成nmol的B2,说明正逆反应速率相等,所以达到平衡状态,故D正确;
故选D。
点评:本题考查化学平衡状态的判断,难度不大,注意分析时要从化学方程式的反应特征判断,平衡状态的本质是正逆反应速率相等,注意反应前后气体体积不变的反应。
本题难度:一般
2、选择题 在一定条件下,某密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ·mol-1。反应达平衡后,SO2、O2、SO3的物质的量之比为3∶2∶4,其他条件不变,升高温度,达到新的平衡时,n(SO2)=1.4 mol,n(O2)=0.9mol,则此时SO3的物质的量为[???? ]
2SO3(g);ΔH=-196.6 kJ·mol-1。反应达平衡后,SO2、O2、SO3的物质的量之比为3∶2∶4,其他条件不变,升高温度,达到新的平衡时,n(SO2)=1.4 mol,n(O2)=0.9mol,则此时SO3的物质的量为[???? ]
A.1.4 mol
B.1.6 mol
C.1.8 mol
D.2.0 mol
参考答案:A
本题解析:
本题难度:一般
3、选择题 浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为(??? )
Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为(??? )
A.绿色变深
B.浅绿色变得更浅
C.变黄
D.无明显变化
参考答案:C
本题解析:
试题分析:浅绿色的Fe(NO3)2溶液中加入稀硫酸发生反应:3Fe2+ + NO3- + 4H+ ="===" 3Fe3+ + NO↑ + 2H2O,Fe2+被氧化为Fe3+,溶液由浅绿色变为黄色,选C。
本题难度:一般
4、选择题 反应:A + 3B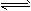 2C + D,在四种不同情况下的反应速率分别为:
2C + D,在四种不同情况下的反应速率分别为:
① ②
②
③ ④
④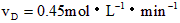
该反应进行得最快的是 [???? ]
A.①
B.④
C.①④
D.②③
参考答案:B
本题解析:
本题难度:简单
5、填空题 830K时,在密闭容器中发生下列可逆反应:

 CO(g)+H2O(g)
CO(g)+H2O(g) CO2(g)+H2(g);△H<0??试回答下列问题:
CO2(g)+H2(g);△H<0??试回答下列问题:
 (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=???????????.
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=???????????.
 (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?????(填“是”与“否”),?此时v(正)正)???v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是???????????????????????????????。
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?????(填“是”与“否”),?此时v(正)正)???v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是???????????????????????????????。
 (3)若降低温度,该反应的K值将????????????????(均填“增大”“减小”或“不变”)。
(3)若降低温度,该反应的K值将????????????????(均填“增大”“减小”或“不变”)。
参考答案:(1)平衡常数K= 1
(2) 否???大于?
本题解析:(1)达到平衡时CO的转化率为60%,则生成CO2和氢气的浓度都是1.2mol/L,此时CO和水蒸气的浓度分别是0.8mol/L、1.8mol/L,所以该反应的平衡常数是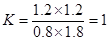 。
。
(2)反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时CO2也是0.5mol/L,而CO和氢气分别是0.5mol/L和1.5mol/L,所以有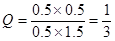 ,即Q<K。所以未达平衡,V(正)>V(逆)。
,即Q<K。所以未达平衡,V(正)>V(逆)。
(3)正反应是放热反应,降低温度,平衡向正反应方向进行,所以平衡常数增大。
本题难度:一般