微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是?[???? ]
A.稀NaOH溶液?????????
B.HCl溶液
C.酸性CuSO4溶液???????
D.酸性AgNO3溶液
2、选择题 现有用离子交换膜(只允许对应的离子通过)和石墨作电极的电解槽电解饱 和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是
和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是

A.气体A是H2 ,溶液E是稀硫酸
B.气体B是H2 ,溶液D是NaOH溶液
C.Na2SO4溶液由G口加入,F口加入稀硫酸
D.靠阳极室一侧的是阳离子交换膜,阴极室导出的是氢气
3、选择题 关于下列图示的说法中不正确的是
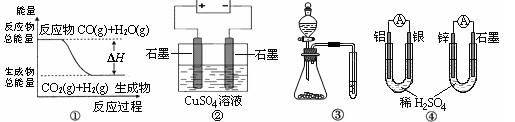
A.图①表示CO(g)+H2O(g) CO2(g)+H2(g)是放热反应
CO2(g)+H2(g)是放热反应
B.图②为电解硫酸铜溶液的装置,电解一段时间后,加入一定量的Cu(OH)2一定不能使溶液恢复到电解前的浓度和体积
C.图③实验装置可一次而又科学准确的完成比较HCl、H2CO3、H2SiO3酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,正极生成气体的物质的量也相同
4、填空题 (10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称

已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  ?Pb+PbO2+4H++2SO42-
?Pb+PbO2+4H++2SO42-
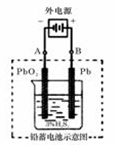
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g。请回答下列问题:

①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
5、填空题 (12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:
。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。
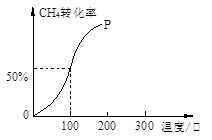
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A c(H2)减少 B 正反应速率加快,逆反应速率减慢
C CH3OH 的物质的量增加 D 重新平衡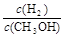 减小
减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
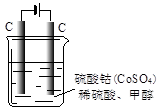
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。