微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质间的转化不能通过一步化合反应实现的是
A.Fe→FeCl3
B.FeCl2→Fe(OH)2
C.FeCl3→FeCl2
D.Fe→Fe3O4
参考答案:B
本题解析:分析:根据物质的性质,分析该物质转化成另一指定物质的反应,选出不是由一步反应实现的一组.
解答:A.铁与氯气发生化合反应生成氯化铁,符合题意,故A正确;
B.FeCl2和可溶性碱发生复分解反应得到Fe(OH)2和盐,不符合题意,故B错误;
C.FeCl3和铁发生化合反应生成FeCl2,符合题意,故C正确;
D.Fe和氧气发生化合反应生成Fe3O4,符合题意,故D正确;
故选B.
点评:本题考查了常见物质间的反应,完成此题,可以依据相关物质的性质进行,难度不大.
本题难度:困难
2、选择题 下列关于浓硫酸的叙述正确的是
A.浓硫酸具有脱水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体
D.因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸
参考答案:A
本题解析:
本题难度:困难
3、选择题 两种气态烃的混合气体0.1mol,完全燃烧后生成0.16molCO2和3.6g水,则混合气体是
A.一定有丙炔
B.一定是甲烷和乙烯
C.一定没有乙烷
D.一定有乙炔
参考答案:C
本题解析:分析:n(H2O)=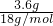 =0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
则混合烃的平均分子式为C1.6H4,根据平均分子式进行判断.
解答:n(H2O)=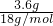 =0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,
则混合烃的平均分子式为C1.6H4,烃中C原子数小于1.6的只有甲烷,则一定含有甲烷,CH4分子中含4个氢原子,故另一种分子中一定含4个氢原子,且其碳原子数大于1.6,故可能是C2H4或C3H4,一定没有C2H6或C2H2,二者的H原子不等于4,
故选C.
点评:本题考查混合烃组成的判断,题目难度中等,本题关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,根据平均分子式进行判断.
本题难度:一般
4、选择题 下列物质转化在给定条件下能实现的是
①AL2O3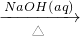 NaALO2(aq)
NaALO2(aq)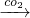 AL(OH)3
AL(OH)3
②S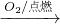 SO3
SO3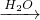 H2SO4
H2SO4
③饱和NaCL(aq)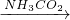 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④Fe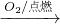 Fe3O4
Fe3O4 FeCL3.
FeCL3.
A.①③
B.②③
C.②④
D.①④
参考答案:A
本题解析:分析:①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝.
②硫燃烧生成二氧化硫.
③在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠.
④四氧化三铁与盐酸反应生成氯化亚铁、氯化铁.
解答:①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,生成氢氧化铝,故①正确;
②硫燃烧生成二氧化硫,不能生成三氧化硫,故②错误;
③在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,析出NaHCO3,加热NaHCO3分解生成碳酸钠,故③正确;
④四氧化三铁中含有+2、+3价的铁,与盐酸反应生成氯化亚铁、氯化铁,不是只有氯化铁,故④错误.
故选:A.
点评:考查元素化合性质、侯德榜制碱法,难度中等,注意侯德榜制碱法要先通氨气,后通二氧化碳,以便获得高浓度离子溶液.
本题难度:一般
5、选择题 以下各组表示卤素及其化合物的性质变化规律中,错误的是
A.得电子能力 F2>Cl2>Br2>I2
B.还原能力 F-C.稳定性 HF>HCl>HBr>HI
D.酸性 HF>HCl>HBr>HI
参考答案:D
本题解析:卤素单质自上往下非金属性在减弱,A正确;对应离子的还原性在增强,B正确;与氢气化合越来越难,对应氢化物的稳定性在变差,C正确;氢化物的酸性依次增强,D错误。答案选D。
本题难度:困难