微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (9分)为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
【方案I】
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL。
问题I—1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸
钙的纯度会????????(填“偏高、偏低、无影响”)。
问题I—2:在方框中画出测定生成的气体体积的装置简图。

【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1 mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升。(已知甲基橙的变色范围是pH=3.1~4.4)
问题II—1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无)?????????;
理由是?????????????????????????????????????????????。
问题II—2:碳酸钙纯度表达式?????????????????????????????????????????。
【方案评价】
你认为以上两个方案中,最好的方案是???????????????????,
另一个方案不够好的理由是????????????????????????????????????????????。
参考答案:1
问题I—1:偏低(1分)
问题I—2:
本题解析:略
本题难度:一般
2、选择题 实验室用自来水制取蒸馏水的方法是[???? ]
A.过滤
B.蒸馏
C.萃取
D.分液
参考答案:B
本题解析:
本题难度:简单
3、实验题 已知粗盐中含有CaCl2、MgCl2及一些可溶性硫酸盐,请根据你所学的知识,将除杂试剂、所除杂质以及除杂时的化学方程式按照除杂顺序填入下表:
试剂加入顺序
| 加入的试剂
| 所除杂质
| 化学方程式
|
①
| ?
| ?
| ?
|
②
| ?
| ?
| ?
|
③
| ?
| ?
| ?
|
④
| ?
| ?
| ?
参考答案:
加入的试剂
所除杂质
化学方程式
本题解析:为了使杂质能除得比较干净,所加试剂一般要过量,而试剂过量又出现引入新杂质的问题,为此,加入试剂的顺序要尽可能使前一过量试剂在后续除杂操作中除去。本题中,加入顺序是BaCl2、NaOH、Na2CO3、盐酸。加过量Na2CO3时可除去过量的BaCl2,最后加盐酸除去过量的NaOH、Na2CO3,当溶液达到中性微酸性时,得到几乎不含杂质的氯化钠溶液。
本题难度:简单
4、选择题 要将含有杂质的工业乙醇提纯,通常采用的方法是
A.蒸馏
B.重结晶
C.过滤
D.萃取
参考答案:A
本题解析:
试题分析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,结晶法适用于不同溶质的溶解度受温度影响不同而分离的一种方法,蒸馏是依据混合物中各个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法。乙醇与水互溶,但沸点(78℃)低于水的,且相差较大,所以要要将含有杂质的工业乙醇提纯,通常采用的方法是蒸馏,答案选A。
本题难度:一般
5、实验题 (10分)欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
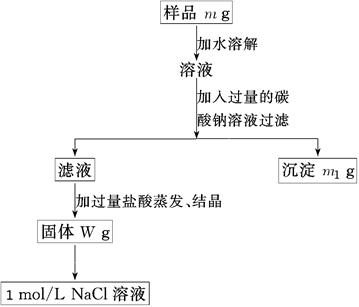
⑴称量粗盐样品m g,样品放在托盘天平左盘上。
⑵过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有????????????????????????。
⑶蒸发操作时应将液体放在___???????___中加热,等加热至____??????____时即停止加热。
⑷在样品的溶液中加入过量的Na2CO3溶液,作用是____________________________,反应的离子方程式是___?????????????????????????????___________________。
⑸在滤液中加入盐酸的作用是________?????????????????????________,发生反应的化学方程式是____???????????????????????????????????????_______。
⑹配制100 mL 1mol/L的NaCl溶液时,应从W g固体中称取NaCl的质量为____________。
参考答案:(10分,每空1分,方程式各2分) (2)漏斗??????
本题解析:
试题分析:(2)过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有漏斗。
(3)蒸发操作时应将液体放在蒸发皿中加热,等加热至剩余较少液体时即停止加热。
(4)氯化钠中含有氯化钙,所以在样品的溶液中加入过量的Na2CO3溶液的作用是使钙离子完全形成沉淀而除去,反应的离子方程式是Ca2++CO32—-===CaCO3↓。
(5)由于碳酸钠是过量的,所以在滤液中加入盐酸的作用是除去过量的Na2CO3,有关反应的化学方程式是Na2CO3+2HCl===2NaCl+H2O+CO2↑。
(6)100 mL 1mol/L的NaCl溶液只溶质的质量是0.1L×0.1mol/L×58.5g/mol=5.85g。由于托盘天平只能读数到0.1g,所以实际称量的质量是5.9g。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
|